修回日期: 2002-12-09
接受日期: 2002-12-25
在线出版日期: 2003-05-15
探讨环氧化酶-2基因在食管上皮癌变进程中的作用及细胞周期相关基因表达的改变, 为环氧化酶-2抑制剂进行食管癌化学预防提供理论依据.
自食管癌高发区采集食管脱落上皮细胞, 对细胞涂片进行病理诊断, 应用流式细胞仪对环氧化酶-2、p53、p21/WAF1及CDK4等基因在食管上皮细胞中的表达进行定量检测.
环氧化酶-2的表达随食管上皮细胞异型性的增高而逐渐增高, 在可疑癌及癌细胞中FI = 1.54±0.27, 100%阳性表达. 突变型p53蛋白及CDK4的表达也随细胞异型性的增高而明显增高, 而抑癌基因p21/WAF1的表达则相反, 其表达在重度增生及可疑癌和癌细胞中明显缺失.
环氧化酶-2在食管上皮癌变进程中表达升高, 并同时伴有细胞周期相关基因表达异常.
引文著录: 齐凤英, 张林西, 韩彩丽, 左连富, 林培中, 郭建文. 食管上皮癌变过程中环氧化酶-2表达上调. 世界华人消化杂志 2003; 11(5): 508-511
Revised: December 9, 2002
Accepted: December 25, 2002
Published online: May 15, 2003
To detect the expression of cyclooxygenase-2 gene and cell cycle related genes in the carcinogenesis of esophageal epithelia, so as to provide theoretical clues to the chemoprevention of esophageal carcinoma.
The samples of esophageal epithelial cells were collected from the high incidence area of esophageal carcinoma. Cell smear slides were made for the evaluation of cell differentiation. The expression of COX-2, p53, p21/WAF1 and CDK4 were detected by flow cytometry.
The expression of COX-2 gene increased with the progression of epithelial cells from low grade dysplasia (LGD) to high grade dysplasia (HGD) or carcinoma. The fluorescence index (FI) was 1.54±0.27 in the carcinoma and suspected carcinoma groups, and the positive rate of COX-2 was 100%. The expression of mutant p53 and CDK4 also increased as the epithelial cells progressed toward carcinoma. But the expression of tumor suppressor gene p21/WAF1 was on the opposite, and its expression sharply decreased in the HGD and carcinoma or suspected carcinoma.
The expression of COX-2 gene significantly increase in the carcinogenesis of esophageal epithelia, and it also has the aberrant expression of cell cycle related genes.
- Citation: Qi FY, Zhang LX, Han CL, Zuo LF, Lin PZ, Guo JW. Up-regulation of cyclooxygenase-2 in carcinogenesis of esophageal epithelia. Shijie Huaren Xiaohua Zazhi 2003; 11(5): 508-511
- URL: https://www.wjgnet.com/1009-3079/full/v11/i5/508.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v11.i5.508
近来研究发现, 环氧化酶-2(Cyclooxygenase-2, COX-2)在结肠癌[1]、胃癌[2]等中表达显著增高, 并可能与癌变有关. 食管癌中COX-2的表达少见报道. 我国食管癌癌前病变中关于COX-2表达的研究还未见报道. COX-2在食管癌变中的作用机制目前还不清楚. 为此, 我们应用食管拉网法对我省食管癌高发区高危人群进行普查, 获取食管上皮细胞标本, 并应用流式细胞术对COX-2及细胞周期相关基因的表达进行定量检测, 探讨COX-2在早期癌变过程中的表达规律及其可能的作用, 为COX-2抑制剂即非类固醇类抗炎药(nonsteroidal anti-inflammatary drugs, NSAIDs)用于高危人群进行化学预防奠定理论基础.
自河北省磁县食管癌高发区现场采集食管上皮细胞标本952例, 其中正常101例, 轻度增生111例, 重度增生I级569例, 重度增生II级138例, 可疑癌14例, 癌19例. 采用食管拉网法, 将拉网器网球上的脱落上皮细胞部分做细胞涂片, 进行细胞学诊断, 其余洗脱到20 ml生理盐水中, 以260目筛网过滤, 离心1500转/ min, 5 min, 弃去上清后加入70%冷乙醇固定, 放入4 ℃冰箱中保存, 以备检测. 从中随机抽取70份样品进行COX-2基因蛋白的检测, 其中正常5例, 轻度增生15例, 重度增生46例, 可疑癌及癌4例. 再从中随机抽取100例进行p53蛋白表达的检测. 其中正常组10例, 轻度增生组24例, 重度增生组62例, 可疑癌及癌4例.另抽取70份样品进行CDK4和p21/WAF1基因蛋白的检测, 其中正常6例, 轻度增生15例, 重度增生39例, 可疑癌及癌10例.
细胞学涂片经常规巴氏染色, 由二位富有经验的病理医师依据沈琼教授分级诊断标准进行细胞学诊断.
1.3.1 试剂 COX-2为羊抗人多克隆抗体, p53为小鼠抗人单克隆抗体, CDK4为小鼠抗人单克隆抗体, p21/WAF1为小鼠抗人单克隆抗体, 工作液浓度均为1:100, Santa Cruz公司产品. 第二抗体分别为兔抗羊FITC-IgG、羊抗鼠FITC-IgG, 工作液浓度为1:100. Jackson Immunoresearch Laboratories, Inc公司产品.
1.3.2 基因蛋白免疫荧光标记方法 采用间接免疫荧光标记方法. 去除样品中的70%乙醇, 用0.01 mol/L PBS缓冲液洗涤2次, 将细胞数调整为1106/ml, 每份样品加入第一抗体工作液100 L. 在37 ℃水浴中温浴30 min. 然后用PBS离心洗涤2次, 弃上清, 每份样品加入第二抗体工作液100 L, 37 ℃水中温浴30 min, 再用PBS离心洗涤2次, 弃上清, 以除去未结合的多余荧光抗体. 上机检测前加入1.0 ml PBS缓冲液经400目筛网过滤, 即可上机检测. 同时设有PBS代替一抗和二抗的阴性对照, 以及只加一抗和二抗的阳性对照.
采用美国B-D公司生产的FACS420型流式细胞仪, 激发光源为2W氩离子激光器, 输出功率300mW, 激发波长为488 nm, 分别进行单参数检测. 结果输入HP-300Consort30计算机进行处理. 测定前以鸡血红细胞作为标准样品调整仪器的CV值在5%以内.
以对数方式采集数据, 并以荧光指数(fluorescence index, FI)表示他们的相对含量, 公式为: FI = (样品基因蛋白荧光强度-正常样品的平均荧光强度)/正常样品的平均荧光强度. 如果FI>1.0为阳性表达, FI≤1.0为阴性表达.
统计学处理 采用SPSS10.0统计软件进行统计分析. 各组间均数比较采用单因素方差分析, 组间多重比较采用Scheffe法. P<0.05时差异有显著性.
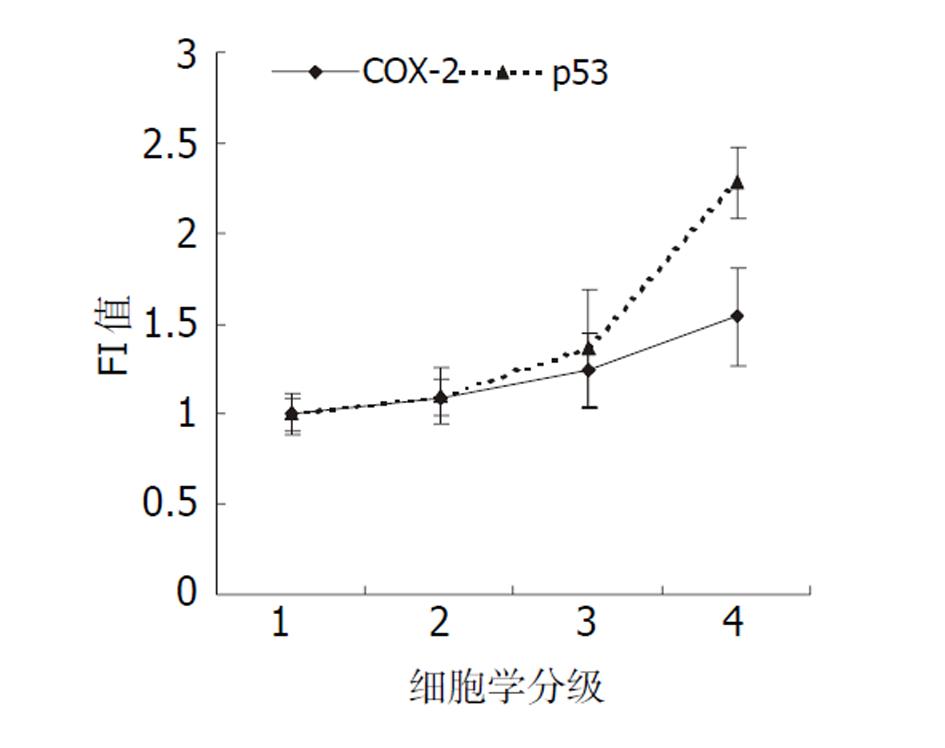
COX-2在正常上皮细胞有少量阳性表达, 因检测例数较少, 故表现为阳性率较高(60%), 但其表达量很低(1.00±0.09). 随上皮细胞异型性增高, COX-2表达明显增高(见图1). 组间COX-2表达的差异具有显著性(F = 8.146, P<0.01). 在可疑癌及癌细胞组COX-2表达的荧光指数(FI)高达1.54±0.27, 100%阳性表达(见表1), 分别与前3组比较差异具有显著性(P<0.05).
| 细胞学分级 | n | FI(mean±SD) | 阳性n(%) |
| 正常组(1) | 5 | 1.00±0.09 | 3(60) |
| 轻增组(2) | 15 | 1.09±0.10 | 12(80) |
| 重增组(3) | 46 | 1.24±0.21 | 39(84.78) |
| 可疑癌及癌(4) | 4 | 1.54±0.27 | 4(100) |
p53蛋白表达也随食管上皮细胞异型性的增高而逐渐增高, 尤其是在可疑癌及癌细胞组表现的尤为突出(见图1). 其表达的阳性率也是随细胞学分级的增高而逐步上升(见表2). 组间比较差异非常显著(F = 27.285, P<0.01); 其中主要是正常组与重增、癌组, 轻增与重增、癌组差异有显著性(P<0.05).
| 细胞学分级 | n | p53 FI(mean±SD) | 阳性n(%) |
| 正常组(1) | 10 | 1.00±0.11 | 0 |
| 轻增组(2) | 24 | 1.10±0.15 | 5(20.8) |
| 重增组(3) | 62 | 1.36±0.32 | 34(54.8) |
| 可疑癌及癌(4) | 4 | 2.28±0.20 | 4(100) |
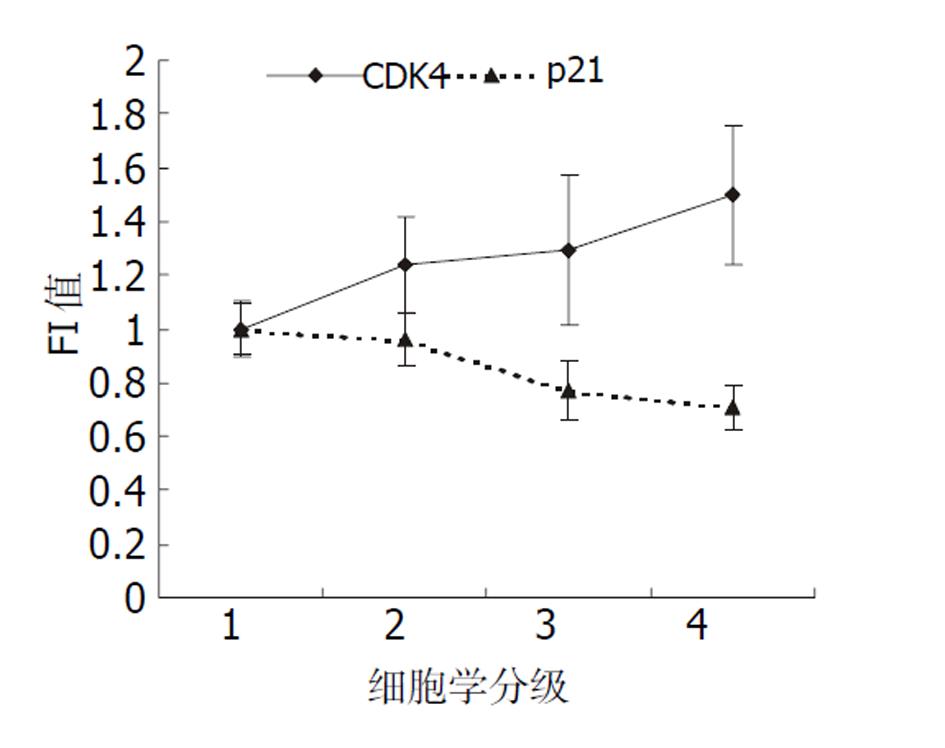
随细胞异型程度的增高CDK4蛋白表达含量也明显增多(见图2), 在可疑癌及癌细胞组FI值达1.50±0.26(见表3); 各组间蛋白表达量差异具有显著性(F = 5.25, P=0.003), 主要是正常细胞组与可疑癌及癌细胞组间差异显著(P<0.01); 而抑癌基因p21/WAF1的表达含量随细胞异型性的增高而逐渐降低(见图2), 在可疑癌及癌细胞组减少最为明显(FI = 0.71±0.08). 各组间表达量的差异具有显著性(F = 23.51, P<0.01). 组间两两比较, 除正常组与轻增组外, 其余各两组间差异具有显著性(P<0.01).
| 细胞学分级 | n | CDK4 FI(mean±SD) | p21 FI(mean±SD) |
| 正常组(1) | 6 | 1.00±0.10 | 1.00±0.09 |
| 轻增组(2) | 15 | 1.24±0.18 | 0.96±0.10 |
| 重增组(3) | 39 | 1.29±0.28 | 0.77±0.11 |
| 可疑癌及癌(4) | 10 | 1.50±0.26 | 0.71±0.08 |
CDK4与p21/WAF1表达呈显著负相关(r =-0.431, P<0.01).
近年来流行病学研究发现, 长期服用阿司匹林等非类固醇类抗炎药(non-steroidal anti-inflammatory drugs, NSAIDs)可降低食管、结肠及胃等部位癌的危险性[3]. Funkhouser et al[4]通过对美国1.4万居民跟踪12-16年流行病学研究发现, 经常服用阿司匹林可使形成食管癌的危险性降低90%. 而阿司匹林、消炎痛等NSAIDs正是COX的抑制剂. 因此提示COX主要是COX-2可能在食管上皮细胞癌变中起重要作用. 因中国的食管癌发生具有明显的地域特征[5], 这也为NSAIDs在高发区进行化学预防提供了新思路.
环氧化酶(cyclooxygenase, COX)又称前列腺素合成酶, 是催化前列腺素合成的限速酶. 现知COX有两种异构酶: COX-1和C0X-2, 二者的氨基酸序列有60%以上同源性. COX-1在大多数哺乳动物组织呈常规表达, 执行"看家"功能, 而COX-2则呈诱导性表达. 目前, 对食管癌中COX-2表达的研究较少. 尤其是中国食管癌中COX-2表达的研究鲜见报道. 本研究采用食管拉网法获取食管上皮细胞, 应用流式细胞术对正常及各级病变中COX-2的表达进行定量检测. 这是对食管癌前病变中COX-2表达定量检测的首次报道.研究发现在正常细胞组基本无COX-2表达, 但随上皮细胞异型性增高, COX-2表达的荧光指数(FI)迅速增高, 尤其在重增组、可疑癌及癌细胞组表现尤为突出. Shamma et al[6]对食管癌变过程中各种病变中COX-2表达进行的检测发现, COX-2表达在重度异型增生上皮中异常增高并认为COX-2对重度异型增生是敏感指标. 而另有学者[7]认为COX-2可能在食管下段鳞癌形成中起一定作用. 食管下段更易发生腺癌, 所以又有人认为[8]COX-2表达可能与食管腺癌形成有关而与鳞癌无关. 总之, COX-2在食管癌形成早期过度表达, 提示其过度表达可能参与了食管上皮的早期癌变进程. 但其作用机制目前还不清楚. 其可能的机制为: (1)COX-2过度表达能促进肿瘤血管生成, 从而促进肿瘤的生长及血道转移[1]; (2)COX-2过度表达抑制了细胞凋亡. 因为有学者研究发现[9,10], 用COX-2选择性或非选择性抑制剂可以抑制癌细胞的生长并诱导其发生凋亡. 但也可能有其他途径存在[11].
越来越多的资料表明: 食管癌的发生与多种癌基因的激活和/或抑癌基因的失活有关. P53及p21/WAF1都是调节细胞周期中G1→S期转变的重要蛋白. 过去对p53、p21/WAF1等的研究, 大多集中在实体癌或癌旁组织. 部分研究显示[12-17], p53或p21在众多癌基因或抑癌基因中是预后标志物. 然而p53及p21等在癌前病变中的表达情况如何少见报道. 本研究中对食管癌高发区食管上皮细胞中p53蛋白的检测发现, 有45.9%(39/85)食管癌前病变中有p53蛋白的积聚, 且随异型性增高, p53蛋白积聚也逐渐增多. 在重增组为54.8%(34/61), 在可疑癌及癌细胞组其FI = 2.28±0.20, 100%阳性表达. 提示癌形成时p53蛋白明显积聚, 基本丧失了对细胞生长的抑制调控. 而抑癌基因p21/WAF1表达随上皮细胞异型性增高而显著减少. 这样抑癌基因p21/WAF1及p53逐渐丧失了对细胞周期的抑制, 尤其是对CDKs的抑制. 同时本研究发现, CDK4表达随细胞异型性增高明显增高, 并且CDK4与p21/WAF1表达呈显著负相关. 而正常细胞周期的控制需要CDK4和抑制蛋白之间的平衡[18]. 无论是抑制蛋白p53的异常积聚或/和p21/WAF1的表达减少/缺失, 还是CDK4的表达增高, 都最终导致食管上皮细胞的细胞增生周期失控, 从而异常增生发生癌变.
关于COX-2表达与细胞周期调控蛋白在食管上皮癌变中的作用国内外还未见报道. 是由于COX-2过度表达从而产生多种花生四烯酸代谢产物(如PGE2、PGF2、PGI等)从而导致的细胞相关基因表达的异常, 还是细胞周期紊乱后相关基因表达异常从而诱导COX-2基因过度表达, 目前还不清楚. 本研究发现, 在食管上皮癌变进展中, COX-2与p53表达都明显升高, 说明COX-2与p53表达可能有一定的相关性. Rajnakova et al[19]对胃癌中COX-2的研究发现, p53阳性积聚的肿瘤中COX-2表达也增强. 并认为COX-2过度表达可促进无p53功能的肿瘤细胞生长. 但也有相反的报道[20].
由此可见, 在食管上皮癌变过程中COX-2表达上调, 并同时伴有细胞周期相关基因表达异常. COX-2在食管上皮癌变进程中的表达及其作用机制还有待进一步研究. 虽然有关研究显示一些非类固醇类抗炎药(NSAIDs)可以诱导食管癌细胞的凋亡, NSAIDs能否应用于食管癌高发区进行预防, 还需要广泛的进一步研究. NSAIDs应用于实际对高危人群进行化学预防还不成熟.
| 1. | Tomozawa S, Tsuno NH, Sunami E, Hatano K, Kitayama J, Osada T, Saito S, Tsuruo T, Shibata Y, Nagawa H. Cyclooxygenase-2 overexpression correlates with tumour recurrence, especially haematogenous metastasis, of colorectal cancer. Br J Cancer. 2000;83:324-328. [PubMed] [DOI] |
| 2. | Ristimaki A, Honkanen N, Jankala H, Sipponen P, Harkonen M. Expression of cyclooxygenase-2 in human gastriccarcinoma. Cancer Res. 1997;57:1276-1280. [PubMed] |
| 3. | Thun MJ, Namboodiri MM, Calle EE, Flanders WD, Heath CW Jr. Aspirin use and risk of fatal cancer. Cancer Res. 1993;53:1322-1327. [PubMed] |
| 4. | Funkhouser EM, Sharp GB. Aspirin and reduced risk of esophageal carcinoma. Cancer. 1995;76:1116-1119. [DOI] |
| 5. | Wang SJ, Wen DG, Zhang J, Man X, Liu H. Intensify standardized therapy for esophageal and stomach cancer in tumor hospitals. World J Gastroenterol. 2001;7:80-82. [PubMed] [DOI] |
| 6. | Shamma A, Yamamoto H, Doki Y, Okami J, Kondo M, Fujiwara Y, Yano M, Inoue M, Matsuura N, Shiozaki H. Up-regulation of cyclooxygenase-2 in squamous carcinogenesis of the esophagus. Clin Cancer Res. 2000;6:1229-1238. [PubMed] |
| 7. | Kawabe A, Shimada Y, Uchida S, Maeda M, Sato F, Itami A, Imamura M. Expression of cyclooxygenase-2 is associated with carcinogenesis of the lower part of thoracic esophageal squamous cell carcinoma and p53 expression. Oncology. 2002;62:46-54. [PubMed] [DOI] |
| 8. | Wang L, Zhang W, Wang W. A study on cyclooxygenase-2 protein expression in esophageal carcinoma and premalignant lesions. Zhonghua Zhongliu Zazhi. 2001;23:14-16. [PubMed] |
| 9. | Souza RF, Shewmake K, Beer DG, Cryer B, Spechler SJ. Selective inhibition of cyclooxygenase-2 suppresses growth and induces apoptosis in human esophageal adenocarcinoma cells. Cancer Res. 2000;60:5767-5772. [PubMed] |
| 10. | Aggarwal S, Taneja N, Lin L, Orringer MB, Rehemtulla A, Beer DG. Indomethacin-induced apoptosis in esophageal adenocarcinoma cells involves upregulation of Bax and translocation of mitochondrial cytochrome C independent of COX-2 expression. Neoplasia. 2000;2:346-356. [DOI] |
| 11. | Li M, Wu X, Xu XC. Induction of apoptosis by cyclo-oxygenase-2 inhibitor NS398 through a cytochrome C-dependent pathway in esophageal cancer cells. Int J Cancer. 2001;93:218-223. [PubMed] [DOI] |
| 12. | Natsugoe S, Nakashima S, Matsumoto M, Xiangming C, Okumura H, Kijima F, Ishigami S, Takebayashi Y, Baba M, Takao S. Expression of p21WAF1/Cip1 in the p53-dependent pathway is related to prognosis in patients with advanced esophageal carcinoma. Clin Cancer Res. 1999;5:2445-2449. [PubMed] |
| 13. | Nita ME, Nagawa H, Tominaga O, Tsuno N, Hatano K, Kitayama J, Tsuruo T, Domene CE, Muto T. P21/Waf1/Cip1 expression is a prognostic marker in curatively resected esophageal squamous cell carcinoma, but not p27 Kip1, p53, or Rb. Ann Surg Oncol. 1999;6:481-488. [DOI] |
| 14. | Kuwahara M, Hirai T, Yoshida K, Yamashita Y, Hihara J, Inoue H, Toge T. p53, p21(Waf/Cip1) and cyclin D1 protein expression and prognosis in esophageal cancer. Dis Esophagus. 1999;12:116-119. [DOI] |
| 15. | Kobayashi S, Koide Y, Endo M, Isono K, Ochiai T. The p53 gene mutation is of prognostic value in esophageal squamous cell carcinoma patients in unified stages of curability. Am J Surg. 1999;177:497-502. [DOI] |
| 16. | Hirai T, Kuwahara M, Yoshida K, Osaki A, Toge T. The prognostic significance of p53, p21 (Waf1/Cip1), and cyclin D1 protein expression in esophageal cancer patients. Anticancer Res. 1999;19:4587-4591. [PubMed] |
| 17. | Xu M, Jin YL, Fu J, Huang H, Chen SZ, Qu P, Tian HM, Liu ZY, Zhang W. The abnormal expression of retinoic acid receptor-beta, p53 and Ki67 protein in normal, premalignant and malignant esophageal tissues. World J Gastroenterol. 2002;8:200-202. [DOI] |
| 18. | Serrano M, Hannon GJ, Beach D. A new regulatory motif in cell-cycle control causing specific inhibition of cyclin D/CDK4. Nature. 1993;366:704-707. [PubMed] [DOI] |
| 19. | Rajnakova A, Moochhala S, Goh PM, Ngoi S. Expression of nitric oxide synthase, cyclooxygenase, and p53 in different stages of human gastric cancer. Cancer Lett. 2001;172:177-185. [DOI] |
| 20. | Sakuma K, Fujimori T, Hirabayashi K, Terano A. Cyclooxygenase(COX)-2 immunoreactivity and relationship to p53 and Ki-67 expression in colorectal cancer. J Gastroenterol. 1999;34:189-194. [DOI] |