Summary
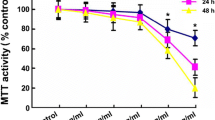
Non-enzymatic glycation of proteins with reducing sugars and subsequent transition metal-catalyzed oxidations leads to the formation of protein-bound „advanced glycation endproducts” (AGEs). They accumulate on long-lived proteins including on and in the vicinity of the β-amyloid plaques in Alzheimer‘s disease (AD). Since the AGE modification of a protein increases with time, and such a „long-term incubation” might also occur in the AD brain, we investigated whether an increase in the cytotoxic effects of an AGE-modified model protein occurs over time. Bovine serum albumin (BSA) was modified by glucose for defined time periods, and the viability of SH-SY5Y neuroblastoma cells, incubated with the differentially AGE-modified BSA samples, was measured with the MTT assay. Cytotoxicity of the AGE-modified BSAs increased in correlation to the incubation time with glucose. Among the AGE-specific markers, browning (OD400) correlated best with cytotoxicity, followed by AGE-specific fluorescence and the defined AGE, carboxymethyllysine. Since AGEs accumulate in AD over time, they may be one of the „age-related” factors contributing to neuronal cell death in Alzheimer‘s disease.
Zusammenfassung
Die nicht-enzymatische Glykierung von Proteinen mit reduzierenden Zuckern und die nachfolgende Oxidation der frühen Reaktionsprodukte durch Übergangsmetalle führt zur Bildung von proteingebundenen „advanced glycation endproducts” (AGEs). AGEs akkumulieren auf langlebigen Proteinen und sind auch struktureller Bestandteil der β-Amyloidplaques bei der Alzheimerschen Demenz (AD). Das AGE-induzierte zytotoxische Potential eines Proteins ist wahrscheinlich direkt abhängig von dem Ausmaß der AGE-Modifikation. Da die AGE-Modifikation eines Proteins unter anderem von der Reaktionszeit bestimmt wird, könnte die lange Lebenszeit der β-Amyloidplaques im AD-Gehirn zu einer hohen lokalen AGE-Konzentration führen, die für den Krankheitsverlauf maßgeblich sein könnte. Bovines Serumalbumin (BSA) wurde durch 1- bis 7-wöchige Inkubation mit Glukose unterschiedlich stark AGE-modifiziert. Die Überlebensrate von SH-SY5Y Neuroblastom-Zellen wurde nach 18-stündiger Inkubation mit diesen verschiedenen AGE-BSAs durch den MTT-Assay bestimmt. Die Zytotoxizität des AGE-modifizierten BSAs erhöhte sich signifikant in Abhängigkeit vom AGE-Modifizierungsgrad, d.h. von der Dauer der Inkubation des BSA mit Glukose. Von den AGE-spezifischen Parametern korrelierte die „Bräunung“ (OD400nm) am besten mit der Zytotoxizität, gefolgt von der AGE-spezifischen Fluoreszenz und der Menge des strukturell definierten AGEs Carboxymethyllysin. Da AGEs in der AD mit der Dauer der Krankheit akkumulieren können, vermuten wir in den AGE-Strukturen einen der „altersbezogenen” Faktoren, die zum Verlust neuronaler Zellfunktionen in der Alzheimerschen Demenz beitragen.
Similar content being viewed by others
Author information
Authors and Affiliations
Additional information
Received: 27 October 2001 /Accepted: 28 October 2001
Rights and permissions
About this article
Cite this article
Gasic-Milenkovic, J., Loske, C., Deuther-Conrad, W. et al. Protein „AGEing”– cytotoxicity of a glycated protein increases with its degree of AGE-modification. Z Gerontol Geriat 34, 457–460 (2001). https://doi.org/10.1007/s003910170018
Issue Date:
DOI: https://doi.org/10.1007/s003910170018