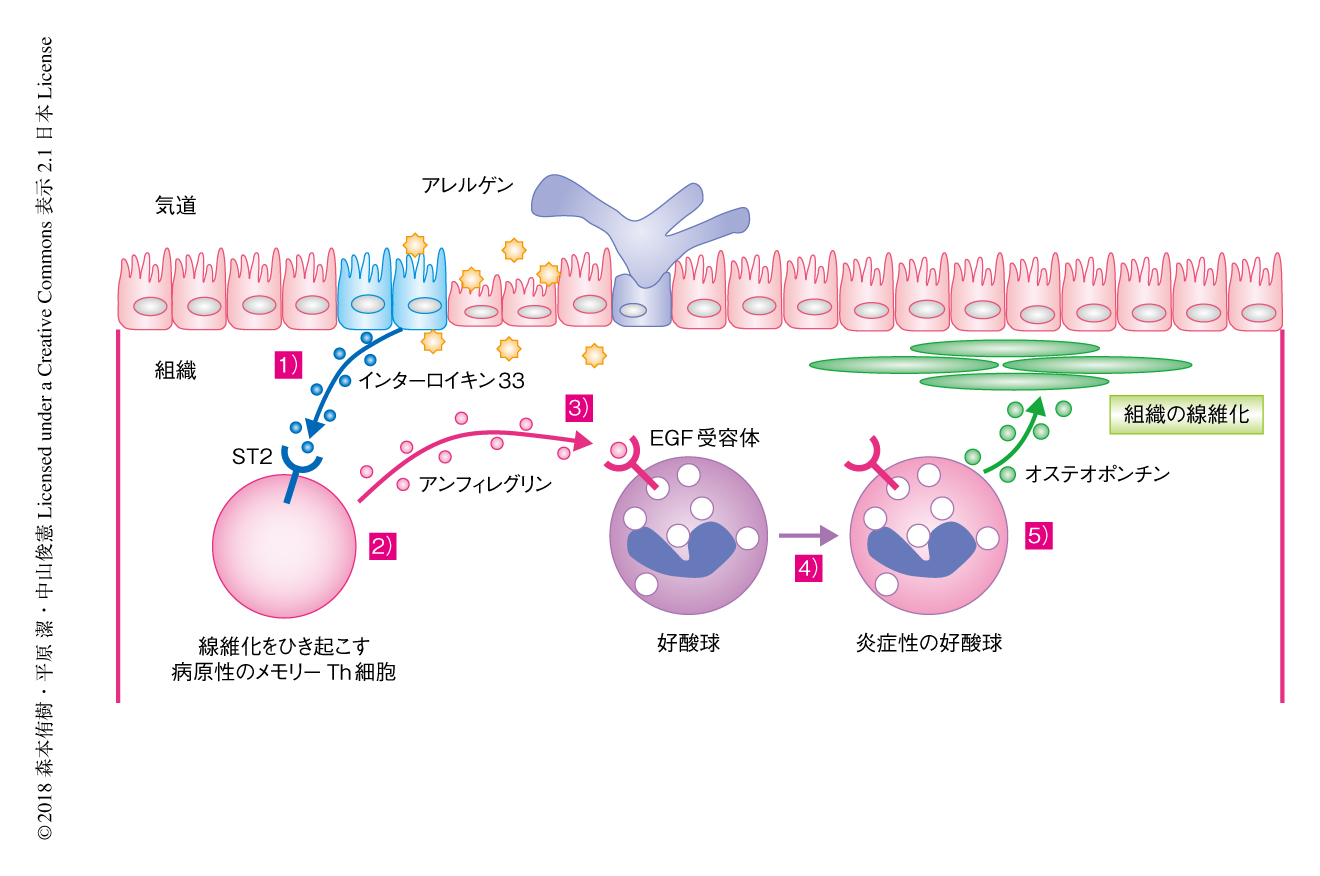
アンフィレグリンを産生するメモリーTh2細胞は好酸球から産生されるオステオポンチンを介し気道の線維化を促進する
森本侑樹・平原 潔・中山俊憲
(千葉大学大学院医学研究科 免疫発生学)
email:森本侑樹,平原 潔,中山俊憲
DOI: 10.7875/first.author.2018.069
Amphiregulin-producing pathogenic memory T helper 2 cells instruct eosinophils to secrete osteopontin and facilitate airway fibrosis.
Yuki Morimoto, Kiyoshi Hirahara, Masahiro Kiuchi, Tomoko Wada, Tomomi Ichikawa, Toshio Kanno, Mikiko Okano, Kota Kokubo, Atsushi Onodera, Daiju Sakurai, Yoshitaka Okamoto, Toshinori Nakayama
Immunity, 49, 134-150.e6 (2018)
メモリーT細胞は免疫記憶をつかさどる細胞として病原体を効率よく排除する一方,喘息など慢性の炎症性疾患の原因となりうる.喘息は気道の線維化をともなう慢性かつアレルギー性の炎症性疾患であるが,組織の線維化がひき起こされる機序は不明である.この研究において,筆者らは,メモリーTh2細胞の亜集団がインターロイキン33の刺激によりアンフィレグリンを多量に産生することを見い出した.さらに,このアンフィレグリンが好酸球を炎症性の好酸球へとリプログラミングし,好酸球からのオステオポンチンの産生を介して気道の線維化を促進することを明らかにした.ヒトにおける好酸球性かつ慢性の炎症性疾患である好酸球性副鼻腔炎の患者に生じるポリープを解析したところ,アンフィレグリンを産生するメモリーTh2細胞およびオステオポンチンを産生する好酸球が認められた.以上の結果より,インターロイキン33-アンフィレグリン-オステオポンチン経路が好酸球性の気道炎症における線維化をひき起こし,この経路は慢性かつアレルギー性の炎症性疾患における組織の線維化に対し新規の治療の標的となりうる可能性が示唆された.
喘息は粘液の過剰な産生,気道過敏性の亢進,気道リモデリングにより特徴づけられる慢性の気道炎症性の疾患である.気管支喘息において気道上皮の肥厚や線維化を含む気道リモデリングは不可逆的な病態として知られている.ステロイドは喘息の治療薬として重要であるが,気道リモデリングに対するステロイドの効果に関してはいまだ議論の余地がある.また,喘息の患者の約5~10%はステロイドによる治療に抵抗性であり,気道リモデリングの程度は重症度と相関するという報告もあるため,気道の線維化に対するステロイドの効果は非常に限定的である.
組織の線維化は,線維芽細胞,筋線維芽細胞,免疫細胞の増殖および活性化の結果として,コラーゲン性および非コラーゲン性の細胞外マトリックスの過剰な沈着からなる1).喘息のような慢性的な炎症により気道は線維化し,これには獲得免疫および自然免疫が関与する1).とくに,Th2細胞(2型ヘルパーT細胞)はアレルギー性の気道炎症において中心的な細胞であることが知られている2).インターロイキン5は好酸球の分化および遊走に重要なサイトカインであり,炎症組織へ好酸球を動員する.活性酸素など好酸球を活性化する炎症メディエーターは気道上皮細胞および神経を傷害し,気道過敏性の亢進や線維化を含む気道リモデリングに関与するが,好酸球が組織の線維化をひき起こす分子機構については不明であった.近年,筆者らは,大量のインターロイキン5を産生する病原性のメモリーTh2細胞が好酸球性の炎症をひき起こすことを報告した2).病原性のメモリーTh2細胞はインターロイキン33の受容体であるST2を高発現し,インターロイキン33の刺激により慢性かつ好酸球性の炎症をひき起こす2-5).アトピー性皮膚炎の患者の皮膚,および,好酸球性食道炎および喘息の患者の末梢血において,多量のインターロイキン5を産生する同様の病原性のTh2細胞が報告されているが,どのようなTh2細胞の集団が組織の線維化に関与するかについては不明であった6,7).
マウスへのハウスダストマイトの反復的な曝露により,喘息を発症した肺においてインターロイキン33を含むサイトカインをコードする遺伝子の発現が上昇するとともに,気道の周囲におけるコラーゲンの沈着が著明に増加した.また,オステオポンチン,テネイシンC,1型コラーゲンα1など線維化に関連するタンパク質をコードする遺伝子の発現も著明に上昇した.インターロイキン33あるいはST2の欠損によりコラーゲンの沈着は減少し,線維化に関連するタンパク質をコードする遺伝子の発現は有意に低下した.卵白アルブミンに特異的なメモリーTh2細胞を移入したのち卵白アルブミンを反復して曝露することによりTh2細胞に依存的な喘息をひき起こした肺においても,線維性の変化の有意な増加が認められた.一方で,ST2を欠損させた卵白アルブミンに特異的なメモリーTh2細胞を移入したマウスの肺においては線維性の変化は減弱した.これらの結果より,気道の線維化においては,メモリーTh2細胞におけるインターロイキン33-ST2経路が重要な役割をはたす可能性が示唆された.
メモリーTh2細胞の産生する気道の線維化をひき起こすタンパク質を同定するため,メモリーTh2細胞におけるインターロイキン33の刺激による遺伝子の発現の変化を網羅的に評価した.その結果,組織の修復に重要なタンパク質であるアンフィレグリンをコードする遺伝子の発現の上昇が認められた5).ST2を高発現するメモリーTh2細胞においては,インターロイキン33の刺激をうけてアンフィレグリンの産生が促進された.アンフィレグリンを産生するメモリーTh2細胞の大部分はインターロイキン5を産生しておらず,アンフィレグリンを産生するTh2細胞の集団と,インターロイキン5を産生するTh2細胞の集団は,異なる細胞集団である可能性が示唆された.さらに,抗原の曝露により,生体において分化したメモリーT細胞からのアンフィレグリンの産生が促進された.以上の結果より,インターロイキン33の刺激によりメモリーTh2細胞によるアンフィレグリンの産生が促進されることが明らかにされた.
アレルギー性の気道の線維化におけるアンフィレグリンの役割について明らかにするため,アンフィレグリンを欠損させたマウスを用いてハウスダストマイトにより発症させた気道の線維性の変化について評価した.野生型のマウスと比較して,アンフィレグリンを欠損させたマウスにおいてはインターロイキン33,インターロイキン5,インターロイキン13をコードする遺伝子の発現,および,炎症を起こした細胞の気道への浸潤については有意な差はみられなかったが,オステオポンチンの沈着など気道の線維化は減弱した.さらに,アンフィレグリンを欠損したメモリーTh2細胞を移入することによりひき起こしたアレルギー性の気道炎症においても,野生型のメモリーTh2細胞を移入したときと比較して気道の線維化は有意に減弱した.これらの結果から,メモリーTh2細胞により産生されるアンフィレグリンが気道の線維化において重要な役割をはたす可能性が示唆された.
喘息を発症した肺においてオステオポンチンを産生する主要な細胞を探索した.その結果,EGF受容体を介してアンフィレグリンの刺激をうけた好酸球がオステオポンチンを産生する主要な細胞であることが明らかにされた.実際に,好酸球をアンフィレグリンで刺激して遺伝子の発現を網羅的な調べたところ,好酸球における遺伝子の発現パターンは劇的に変化した.アンフィレグリンの刺激をうけた好酸球は,炎症性の好酸球に特徴的な遺伝子の発現の上昇,および,CD101の発現の上昇およびCD62Lの発現の低下を示し,炎症性の好酸球の特徴を示した8).以上の結果より,アンフィレグリンによりリプログラミングされた炎症性の好酸球がオステオポンチンを産生することが示唆された.
オステオポンチンの線維化への直接的な作用を評価する目的で,線維芽細胞と野生型の好酸球あるいはオステオポンチンを欠損した好酸球を共培養した.その結果,オステオポンチンを欠損した好酸球と共培養した線維芽細胞において,線維化に関連するタンパク質をコードする遺伝子の発現は著明に低下した.さらに,オステオポンチンを欠損させたマウスに喘息をひき起こしたところ,肺において線維性の変化が減弱した.また,オステオポンチンを欠損した好酸球を移入したマウスに喘息をひき起こしたところ,肺において線維性の変化は減弱し,好酸球の産生するオステオポンチンが気道の線維化をひき起こす可能性が示唆された.
EGF受容体を介したアンフィレグリンの刺激の阻害が気道の線維化にどのような影響をおよぼすのか評価した.EGF受容体チロシンキナーゼ阻害剤であるエルロチニブの存在下において好酸球にアンフィレグリンをくわえたところ,オステオポンチンをコードする遺伝子の発現が阻害された.また,喘息をひき起こしたマウスに対し抗原の曝露と同時にエルロチニブを投与したところ,肺における線維性の変化が阻害された.さらに,抗原の曝露により気道に線維化をひき起こしたのちエルロチニブを投与したところ,線維化は改善された.以上の結果から,好酸球におけるアンフィレグリン-EGF受容体-オステオポンチン経路が組織の線維化をひき起こす一方,その阻害により線維化が改善される可能性が示唆された.
ここまで述べたような機序がヒトの好酸球性かつ慢性の炎症性疾患における病態の形成に関与するかどうかを調べる目的で,好酸球性副鼻腔炎に着目した.好酸球性副鼻腔炎は鼻副鼻腔に好酸球が著明に浸潤したポリープを呈する慢性の上気道炎症性の疾患である.正常な鼻粘膜と比較して,好酸球性副鼻腔炎の患者のポリープにおいてはフィブロネクチンの沈着が有意に増加すると同時に,オステオポンチン,テネイシンC,1型コラーゲンα1など線維化に関連するタンパク質をコードする遺伝子の発現も有意に上昇していた.さらに,アンフィレグリン,インターロイキン33,Th2サイトカインをコードする遺伝子の発現も有意に上昇していた.フローサイトメトリー法による解析の結果,患者のポリープにおいてアンフィレグリンはおもにCD45RO陽性CD4陽性のメモリーT細胞により産生されており,自然リンパ球からの産生はわずかであった.患者のポリープに浸潤するCD45RO陽性CD4陽性のメモリー記憶型T細胞のうち,CD161およびCRTH2を高発現するT細胞が特異的にアンフィレグリンを産生していた.免疫組織学的な解析により,患者のポリープにおいてオステオポンチンを高発現する好酸球の著明な浸潤が認められた.ポリープに浸潤する好酸球は,同じ患者から得られた末梢血の好酸球と比較して,オステオポンチンをコードする遺伝子の発現が有意に上昇していた.さらに,健康な被験者から得られた末梢血の好酸球はアンフィレグリンの刺激によりオステオポンチンをコードする遺伝子の発現が誘導された一方,EGF受容体チロシンキナーゼ阻害剤であるエルロチニブはアンフィレグリンによるオステオポンチンをコードする遺伝子の発現を抑制した.以上の結果より,線維性の変化をきたしている好酸球性副鼻腔炎の患者のポリープにおいては,アンフィレグリンを産生するメモリーT細胞およびオステオポンチンを発現する好酸球が存在することが明らかにされた.
この研究において,筆者らは,ST2を高発現するメモリーTh2細胞と好酸球とのあいだのインターロイキン33-アンフィレグリン-オステオポンチン経路により,慢性かつアレルギー性の炎症において気道の線維化が制御されることを明らかにした(図1).
アンフィレグリンは筋肉および肺において組織の修復に関与し,組織のホメオスタシスに寄与すること報告されている.慢性炎症による制御の不能な組織の修復は線維症をひき起こすと考えられているが,これまで,線維症の発症におけるアンフィレグリンの病原性については不明であった.この研究において,アンフィレグリンを欠損させたマウスに喘息をひき起こしたところ,肺において線維性の変化の改善が認められ,アンフィレグリンが気道炎症における線維化におけて病態の形成に関与することが示唆された.
さらに,好酸球がアンフィレグリンの標的となる重要な細胞であることも明らかにされた.遺伝子の発現の網羅的な解析により,アンフィレグリンの刺激が好酸球において炎症性の遺伝子の発現の上昇をともなうリプログラミングをひき起こすことが明らかにされた.好酸球におけるアンフィレグリンの刺激により発現の上昇する遺伝子のひとつは,線維化した組織における非コラーゲン性の細胞外マトリックスの主要な構成タンパク質であり線維症に寄与するオステオポンチンをコードする遺伝子であった9).難治性の喘息は,しばしば組織の線維化と関連して肺の機能の低下をもたらすが,好酸球が非コラーゲン性の細胞外マトリックスを直接的に産生し,アレルギー性の気道炎症における組織の線維化に関与する可能性が示唆された.
また,ヒトの検体を用いた解析においては,マウスの結果と同様に,好酸球性副鼻腔炎の患者に生じるポリープに浸潤するCD161およびCRTH2を高発現するメモリーT細胞の集団には,インターロイキン5を産生するT細胞の集団,および,アンフィレグリンを産生するT細胞の集団の異なる2つのT細胞の集団が存在することが明らかにされた.病原性のメモリーT細胞の性質をより深く理解するため,今後,アンフィレグリンを産生するT細胞の集団の詳細な解析が必要である.
この研究により,アンフィレグリン-オステオポンチン経路は好酸球性副鼻腔炎を含むステロイドによる治療に対し抵抗性を示す好酸球性の炎症性疾患の患者にとり,新規の治療の戦略となりうることが示された.
略歴:2017年 千葉大学大学院医学薬学府博士課程 修了,同年より千葉大学未来医療教育研究センター 特任助教.
研究テーマ:アレルギー性の気道炎症の病態の形成における病原性のT細胞の役割.
関心事:免疫系と神経系との相互作用.
平原 潔(Kiyoshi Hirahara)
千葉大学大学院医学研究院 准教授.
中山 俊憲(Toshinori Nakayama)
千葉大学大学院医学研究院 教授.
研究室URL:http://www.m.chiba-u.ac.jp/class/meneki/
© 2018 森本侑樹・平原 潔・中山俊憲 Licensed under CC 表示 2.1 日本
(千葉大学大学院医学研究科 免疫発生学)
email:森本侑樹,平原 潔,中山俊憲
DOI: 10.7875/first.author.2018.069
Amphiregulin-producing pathogenic memory T helper 2 cells instruct eosinophils to secrete osteopontin and facilitate airway fibrosis.
Yuki Morimoto, Kiyoshi Hirahara, Masahiro Kiuchi, Tomoko Wada, Tomomi Ichikawa, Toshio Kanno, Mikiko Okano, Kota Kokubo, Atsushi Onodera, Daiju Sakurai, Yoshitaka Okamoto, Toshinori Nakayama
Immunity, 49, 134-150.e6 (2018)
要 約
メモリーT細胞は免疫記憶をつかさどる細胞として病原体を効率よく排除する一方,喘息など慢性の炎症性疾患の原因となりうる.喘息は気道の線維化をともなう慢性かつアレルギー性の炎症性疾患であるが,組織の線維化がひき起こされる機序は不明である.この研究において,筆者らは,メモリーTh2細胞の亜集団がインターロイキン33の刺激によりアンフィレグリンを多量に産生することを見い出した.さらに,このアンフィレグリンが好酸球を炎症性の好酸球へとリプログラミングし,好酸球からのオステオポンチンの産生を介して気道の線維化を促進することを明らかにした.ヒトにおける好酸球性かつ慢性の炎症性疾患である好酸球性副鼻腔炎の患者に生じるポリープを解析したところ,アンフィレグリンを産生するメモリーTh2細胞およびオステオポンチンを産生する好酸球が認められた.以上の結果より,インターロイキン33-アンフィレグリン-オステオポンチン経路が好酸球性の気道炎症における線維化をひき起こし,この経路は慢性かつアレルギー性の炎症性疾患における組織の線維化に対し新規の治療の標的となりうる可能性が示唆された.
はじめに
喘息は粘液の過剰な産生,気道過敏性の亢進,気道リモデリングにより特徴づけられる慢性の気道炎症性の疾患である.気管支喘息において気道上皮の肥厚や線維化を含む気道リモデリングは不可逆的な病態として知られている.ステロイドは喘息の治療薬として重要であるが,気道リモデリングに対するステロイドの効果に関してはいまだ議論の余地がある.また,喘息の患者の約5~10%はステロイドによる治療に抵抗性であり,気道リモデリングの程度は重症度と相関するという報告もあるため,気道の線維化に対するステロイドの効果は非常に限定的である.
組織の線維化は,線維芽細胞,筋線維芽細胞,免疫細胞の増殖および活性化の結果として,コラーゲン性および非コラーゲン性の細胞外マトリックスの過剰な沈着からなる1).喘息のような慢性的な炎症により気道は線維化し,これには獲得免疫および自然免疫が関与する1).とくに,Th2細胞(2型ヘルパーT細胞)はアレルギー性の気道炎症において中心的な細胞であることが知られている2).インターロイキン5は好酸球の分化および遊走に重要なサイトカインであり,炎症組織へ好酸球を動員する.活性酸素など好酸球を活性化する炎症メディエーターは気道上皮細胞および神経を傷害し,気道過敏性の亢進や線維化を含む気道リモデリングに関与するが,好酸球が組織の線維化をひき起こす分子機構については不明であった.近年,筆者らは,大量のインターロイキン5を産生する病原性のメモリーTh2細胞が好酸球性の炎症をひき起こすことを報告した2).病原性のメモリーTh2細胞はインターロイキン33の受容体であるST2を高発現し,インターロイキン33の刺激により慢性かつ好酸球性の炎症をひき起こす2-5).アトピー性皮膚炎の患者の皮膚,および,好酸球性食道炎および喘息の患者の末梢血において,多量のインターロイキン5を産生する同様の病原性のTh2細胞が報告されているが,どのようなTh2細胞の集団が組織の線維化に関与するかについては不明であった6,7).
1.喘息における気道の線維化はインターロイキン33-ST2経路を介してひき起こされる
マウスへのハウスダストマイトの反復的な曝露により,喘息を発症した肺においてインターロイキン33を含むサイトカインをコードする遺伝子の発現が上昇するとともに,気道の周囲におけるコラーゲンの沈着が著明に増加した.また,オステオポンチン,テネイシンC,1型コラーゲンα1など線維化に関連するタンパク質をコードする遺伝子の発現も著明に上昇した.インターロイキン33あるいはST2の欠損によりコラーゲンの沈着は減少し,線維化に関連するタンパク質をコードする遺伝子の発現は有意に低下した.卵白アルブミンに特異的なメモリーTh2細胞を移入したのち卵白アルブミンを反復して曝露することによりTh2細胞に依存的な喘息をひき起こした肺においても,線維性の変化の有意な増加が認められた.一方で,ST2を欠損させた卵白アルブミンに特異的なメモリーTh2細胞を移入したマウスの肺においては線維性の変化は減弱した.これらの結果より,気道の線維化においては,メモリーTh2細胞におけるインターロイキン33-ST2経路が重要な役割をはたす可能性が示唆された.
2.インターロイキン33の刺激はメモリーTh2細胞においてアンフィレグリンの産生を促進する
メモリーTh2細胞の産生する気道の線維化をひき起こすタンパク質を同定するため,メモリーTh2細胞におけるインターロイキン33の刺激による遺伝子の発現の変化を網羅的に評価した.その結果,組織の修復に重要なタンパク質であるアンフィレグリンをコードする遺伝子の発現の上昇が認められた5).ST2を高発現するメモリーTh2細胞においては,インターロイキン33の刺激をうけてアンフィレグリンの産生が促進された.アンフィレグリンを産生するメモリーTh2細胞の大部分はインターロイキン5を産生しておらず,アンフィレグリンを産生するTh2細胞の集団と,インターロイキン5を産生するTh2細胞の集団は,異なる細胞集団である可能性が示唆された.さらに,抗原の曝露により,生体において分化したメモリーT細胞からのアンフィレグリンの産生が促進された.以上の結果より,インターロイキン33の刺激によりメモリーTh2細胞によるアンフィレグリンの産生が促進されることが明らかにされた.
3.メモリーTh2細胞の産生するアンフィレグリンは喘息において気道の線維化をひき起こす
アレルギー性の気道の線維化におけるアンフィレグリンの役割について明らかにするため,アンフィレグリンを欠損させたマウスを用いてハウスダストマイトにより発症させた気道の線維性の変化について評価した.野生型のマウスと比較して,アンフィレグリンを欠損させたマウスにおいてはインターロイキン33,インターロイキン5,インターロイキン13をコードする遺伝子の発現,および,炎症を起こした細胞の気道への浸潤については有意な差はみられなかったが,オステオポンチンの沈着など気道の線維化は減弱した.さらに,アンフィレグリンを欠損したメモリーTh2細胞を移入することによりひき起こしたアレルギー性の気道炎症においても,野生型のメモリーTh2細胞を移入したときと比較して気道の線維化は有意に減弱した.これらの結果から,メモリーTh2細胞により産生されるアンフィレグリンが気道の線維化において重要な役割をはたす可能性が示唆された.
4.アンフィレグリンは好酸球を炎症性の好酸球にリプログラミングしオステオポンチンの産生を促進する
喘息を発症した肺においてオステオポンチンを産生する主要な細胞を探索した.その結果,EGF受容体を介してアンフィレグリンの刺激をうけた好酸球がオステオポンチンを産生する主要な細胞であることが明らかにされた.実際に,好酸球をアンフィレグリンで刺激して遺伝子の発現を網羅的な調べたところ,好酸球における遺伝子の発現パターンは劇的に変化した.アンフィレグリンの刺激をうけた好酸球は,炎症性の好酸球に特徴的な遺伝子の発現の上昇,および,CD101の発現の上昇およびCD62Lの発現の低下を示し,炎症性の好酸球の特徴を示した8).以上の結果より,アンフィレグリンによりリプログラミングされた炎症性の好酸球がオステオポンチンを産生することが示唆された.
5.好酸球の産生するオステオポンチンは線維化に重要でありEGF受容体シグナルの阻害により線維化は改善する
オステオポンチンの線維化への直接的な作用を評価する目的で,線維芽細胞と野生型の好酸球あるいはオステオポンチンを欠損した好酸球を共培養した.その結果,オステオポンチンを欠損した好酸球と共培養した線維芽細胞において,線維化に関連するタンパク質をコードする遺伝子の発現は著明に低下した.さらに,オステオポンチンを欠損させたマウスに喘息をひき起こしたところ,肺において線維性の変化が減弱した.また,オステオポンチンを欠損した好酸球を移入したマウスに喘息をひき起こしたところ,肺において線維性の変化は減弱し,好酸球の産生するオステオポンチンが気道の線維化をひき起こす可能性が示唆された.
EGF受容体を介したアンフィレグリンの刺激の阻害が気道の線維化にどのような影響をおよぼすのか評価した.EGF受容体チロシンキナーゼ阻害剤であるエルロチニブの存在下において好酸球にアンフィレグリンをくわえたところ,オステオポンチンをコードする遺伝子の発現が阻害された.また,喘息をひき起こしたマウスに対し抗原の曝露と同時にエルロチニブを投与したところ,肺における線維性の変化が阻害された.さらに,抗原の曝露により気道に線維化をひき起こしたのちエルロチニブを投与したところ,線維化は改善された.以上の結果から,好酸球におけるアンフィレグリン-EGF受容体-オステオポンチン経路が組織の線維化をひき起こす一方,その阻害により線維化が改善される可能性が示唆された.
6.線維化したヒトの組織においてもアンフィレグリンを産生するメモリーT細胞およびオステオポンチンを発現する好酸球が存在する
ここまで述べたような機序がヒトの好酸球性かつ慢性の炎症性疾患における病態の形成に関与するかどうかを調べる目的で,好酸球性副鼻腔炎に着目した.好酸球性副鼻腔炎は鼻副鼻腔に好酸球が著明に浸潤したポリープを呈する慢性の上気道炎症性の疾患である.正常な鼻粘膜と比較して,好酸球性副鼻腔炎の患者のポリープにおいてはフィブロネクチンの沈着が有意に増加すると同時に,オステオポンチン,テネイシンC,1型コラーゲンα1など線維化に関連するタンパク質をコードする遺伝子の発現も有意に上昇していた.さらに,アンフィレグリン,インターロイキン33,Th2サイトカインをコードする遺伝子の発現も有意に上昇していた.フローサイトメトリー法による解析の結果,患者のポリープにおいてアンフィレグリンはおもにCD45RO陽性CD4陽性のメモリーT細胞により産生されており,自然リンパ球からの産生はわずかであった.患者のポリープに浸潤するCD45RO陽性CD4陽性のメモリー記憶型T細胞のうち,CD161およびCRTH2を高発現するT細胞が特異的にアンフィレグリンを産生していた.免疫組織学的な解析により,患者のポリープにおいてオステオポンチンを高発現する好酸球の著明な浸潤が認められた.ポリープに浸潤する好酸球は,同じ患者から得られた末梢血の好酸球と比較して,オステオポンチンをコードする遺伝子の発現が有意に上昇していた.さらに,健康な被験者から得られた末梢血の好酸球はアンフィレグリンの刺激によりオステオポンチンをコードする遺伝子の発現が誘導された一方,EGF受容体チロシンキナーゼ阻害剤であるエルロチニブはアンフィレグリンによるオステオポンチンをコードする遺伝子の発現を抑制した.以上の結果より,線維性の変化をきたしている好酸球性副鼻腔炎の患者のポリープにおいては,アンフィレグリンを産生するメモリーT細胞およびオステオポンチンを発現する好酸球が存在することが明らかにされた.
おわりに
この研究において,筆者らは,ST2を高発現するメモリーTh2細胞と好酸球とのあいだのインターロイキン33-アンフィレグリン-オステオポンチン経路により,慢性かつアレルギー性の炎症において気道の線維化が制御されることを明らかにした(図1).
アンフィレグリンは筋肉および肺において組織の修復に関与し,組織のホメオスタシスに寄与すること報告されている.慢性炎症による制御の不能な組織の修復は線維症をひき起こすと考えられているが,これまで,線維症の発症におけるアンフィレグリンの病原性については不明であった.この研究において,アンフィレグリンを欠損させたマウスに喘息をひき起こしたところ,肺において線維性の変化の改善が認められ,アンフィレグリンが気道炎症における線維化におけて病態の形成に関与することが示唆された.
さらに,好酸球がアンフィレグリンの標的となる重要な細胞であることも明らかにされた.遺伝子の発現の網羅的な解析により,アンフィレグリンの刺激が好酸球において炎症性の遺伝子の発現の上昇をともなうリプログラミングをひき起こすことが明らかにされた.好酸球におけるアンフィレグリンの刺激により発現の上昇する遺伝子のひとつは,線維化した組織における非コラーゲン性の細胞外マトリックスの主要な構成タンパク質であり線維症に寄与するオステオポンチンをコードする遺伝子であった9).難治性の喘息は,しばしば組織の線維化と関連して肺の機能の低下をもたらすが,好酸球が非コラーゲン性の細胞外マトリックスを直接的に産生し,アレルギー性の気道炎症における組織の線維化に関与する可能性が示唆された.
また,ヒトの検体を用いた解析においては,マウスの結果と同様に,好酸球性副鼻腔炎の患者に生じるポリープに浸潤するCD161およびCRTH2を高発現するメモリーT細胞の集団には,インターロイキン5を産生するT細胞の集団,および,アンフィレグリンを産生するT細胞の集団の異なる2つのT細胞の集団が存在することが明らかにされた.病原性のメモリーT細胞の性質をより深く理解するため,今後,アンフィレグリンを産生するT細胞の集団の詳細な解析が必要である.
この研究により,アンフィレグリン-オステオポンチン経路は好酸球性副鼻腔炎を含むステロイドによる治療に対し抵抗性を示す好酸球性の炎症性疾患の患者にとり,新規の治療の戦略となりうることが示された.
文 献
- Wick, G., Grundtman, C., Mayerl, C. et al.: The immunology of fibrosis. Annu. Rev. Immunol., 31, 107-135 (2013)[PubMed]
- Nakayama, T., Hirahara, K., Onodera, A. et al.: Th2 cells in health and disease. Annu. Rev. Immunol., 35, 53-84 (2017)[PubMed]
- Endo, Y., Iwamura, C., Kuwahara, M. et al.: Eomesodermin controls interleukin-5 production in memory T helper 2 cells through inhibition of activity of the transcription factor GATA3. Immunity, 35, 733-745 (2011)[PubMed]
- Endo, Y., Hirahara, K., Iinuma, T. et al.: The interleukin-33-p38 kinase axis confers memory T helper 2 cell pathogenicity in the airway. Immunity, 42, 294-308 (2015)[PubMed] [新着論文レビュー]
- Shinoda, K., Hirahara, K., Iinuma, T. et al.: Thy1+IL-7+ lymphatic endothelial cells in iBALT provide a survival niche for memory T-helper cells in allergic airway inflammation. Proc. Natl. Acad. Sci. USA, 113, E2842-E2851 (2016)[PubMed]
- Mitson-Salazar, A., Yin, Y., Wansley, D. L. et al.: Hematopoietic prostaglandin D synthase defines a proeosinophilic pathogenic effector human TH2 cell subpopulation with enhanced function. J. Allergy Clin. Immunol., 137, 907-918.e909 (2016)[PubMed]
- Wambre, E., Bajzik, V., DeLong, J. H. et al.: A phenotypically and functionally distinct human TH2 cell subpopulation is associated with allergic disorders. Sci. Transl. Med., 9, eaam9171 (2017)[PubMed]
- Stoll, S., Garner, W. & Elder, J.: Heparin-binding ligands mediate autocrine epidermal growth factor receptor activation in skin organ culture. J. Clin. Invest., 100, 1271-1281 (1997)[PubMed]
- Sabo-Attwood, T., Ramos-Nino, M. E., Eugenia-Ariza, M. et al.: Osteopontin modulates inflammation, mucin production, and gene expression signatures after inhalation of asbestos in a murine model of fibrosis. Am. J. Pathol., 178, 1975-1985 (2011)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:2017年 千葉大学大学院医学薬学府博士課程 修了,同年より千葉大学未来医療教育研究センター 特任助教.
研究テーマ:アレルギー性の気道炎症の病態の形成における病原性のT細胞の役割.
関心事:免疫系と神経系との相互作用.
平原 潔(Kiyoshi Hirahara)
千葉大学大学院医学研究院 准教授.
中山 俊憲(Toshinori Nakayama)
千葉大学大学院医学研究院 教授.
研究室URL:http://www.m.chiba-u.ac.jp/class/meneki/
© 2018 森本侑樹・平原 潔・中山俊憲 Licensed under CC 表示 2.1 日本