低分子化合物によるin vitroにおける成熟した肝細胞から肝前駆細胞へのリプログラミング
勝田 毅・落谷孝広
(国立がんセンター研究所 分子細胞治療研究分野)
email:落谷孝広
DOI: 10.7875/first.author.2016.123
Conversion of terminally committed hepatocytes to culturable bipotent progenitor cells with regenerative capacity.
Takeshi Katsuda, Masaki Kawamata, Keitaro Hagiwara, Ryou-u Takahashi, Yusuke Yamamoto, Fernando D. Camargo, Takahiro Ochiya
Cell Stem Cell, 20, 41-55 (2017)
肝臓の再生医療における重大な問題は,移植の可能な肝細胞あるいはその前駆細胞をin vitroにおいて増殖させ安定に供給するすべのないことである.筆者らは,この研究において,低分子化合物を用いてラットおよびマウスの肝細胞を肝細胞および胆管上皮細胞の両方への分化能をもつ肝前駆細胞へとリプログラミングできることを明らかにした.CLiPと命名されたこの肝前駆細胞は,増殖能を失うことなく,しかも,肝細胞への再分化能を維持した状態で長期間にわたり安定に培養することができた.さらには,ラットのCLiPを肝臓に重度の障害をもつ免疫不全マウスに移植したところ,がん化をともなうことなく障害された肝臓の75~90%が置換された.この成果は,肝臓の再生医療のあり方を一新しその実現に貢献する可能性がある.さらに,最近の報告から,慢性的に障害にさらされた肝臓において肝細胞が肝前駆細胞へとリプログラミングされることが明らかにされており,この研究は,この現象を理解するうえでも重要な知見になることが期待される.
肝臓は唯一,再生能をもつことが知られている臓器であるが,慢性的に障害にさらされつづけるとその再生能は低下し,線維化や肝硬変へと進行して,最終的には肝がんがひき起こされる.現在のところ,このような重篤な肝疾患に対する治療法は肝臓の移植のみであるが,絶対的なドナーの不足が問題になっている.そのため,近年,多能性幹細胞から肝細胞を生体外で供給することが試みられている.しかし,多能性幹細胞から肝細胞へと分化させることはむずかしく,肝臓が障害された動物へ移植してもその再生能はきわめて低い.そのため,移植に使える肝細胞を生体外で安定に供給できる技術が強くもとめられている.
一方,肝臓のなかには肝細胞とよく似ているがそれよりも小さく機能的にやや未熟な小型肝細胞という名で知られる細胞の存在することが知られている1).小型肝細胞は通常の肝細胞とは異なり生体外でも増殖できることから肝細胞の供給源になりうるとの見方もある.しかし,その増殖能も一時的なものであり長期にわたり継代培養することはできない.
これまで,筆者らの研究室においては,4つの低分子化合物を用いることによりラットのES細胞をはじめさまざまな幹細胞および前駆細胞を安定に培養できることを明らかにしてきた2,3).そこで,小型肝細胞が実際に前駆細胞としての性質をもつのであれば,これらの低分子化合物を用いて安定に培養できるのではないかと考えた.
小型肝細胞が生体外で増殖能を維持できるようになるかどうかを検討するため,4つの低分子化合物(Y-27632,PD0325901,A-83-01,CHIR99021)のすべての組合せを培養液に添加し,ラットから採取した小型肝細胞の増殖能を評価するというミニスクリーニングを実施した.この際,増殖する細胞が小型肝細胞であることを担保するため,陰性対照として成熟した肝細胞も同様の条件で培養した.その結果,小型肝細胞だけでなく成熟した肝細胞までもが複数の低分子化合物の組合せのもとで増殖した.とくに,ROCK阻害剤であるY-27632,TGFβ阻害剤であるA-83-01,GSK3阻害剤であるCHIR99021の3つの組合せを添加したときに肝細胞の増殖能はもっとも高くなり,2週間の培養により細胞の数は約30倍に増殖した.そこで,肝細胞からこの3つの低分子化合物の組合せにより誘導される増殖性の細胞に焦点をあてた.
3つの低分子化合物の組合せにより誘導された増殖性の細胞は,形態的に明らかに肝細胞とは異なる細胞へと変化した.この細胞は肝細胞に比べ大きさは小さく,核と細胞質の比が高かった.このような形態は,肝細胞への運命づけがなされるまえの胎児の肝臓にみられる肝前駆細胞(肝芽細胞)に似ていた.実際に,免疫染色および遺伝子の発現解析により,この増殖性の細胞は一連の肝芽細胞のマーカーを発現していることが明らかにされ,成熟した肝細胞から前駆細胞の状態へと変化していることが強く示唆された.
この細胞が表現型としても前駆細胞へと変化しているかどうか検討した.発生の過程において内胚葉から分化した肝芽細胞は,増殖しながら肝臓のもとになる器官である肝芽を形成する.そして,周辺の環境からのシグナルに応じて肝芽の細胞はしだいに肝細胞あるいは胆管上皮細胞へと分化し,肝芽は肝臓へと成長する.これにならい,3つの低分子化合物の組合せにより誘導された増殖性の細胞がそうした2方向への分化能を示すかどうか検討した.肝芽の細胞を肝細胞へと成熟させるプロトコールを用いてこの増殖性の細胞を培養したところ,これらの細胞はすみやかに成熟した肝細胞様の形態へと変化し,薬物代謝やグリコーゲンの蓄積といった肝臓の機能を獲得した.一方,管腔構造の形成を促進する細胞外基質を含む培養液において培養したところ,この増殖性の細胞はネットワーク状の管腔構造を形成した.免疫染色および遺伝子の発現解析の結果,この管腔構造において胆管のマーカーの発現が確認された.さらに,この管腔構造を形成した細胞をセクレチンにより刺激したところ管腔の内部への水の輸送が促進され,また,胆汁を模倣した物質を添加したところ管腔の内部への胆汁の排泄が確かめられ,構築された管腔構造は機能的な胆管の性質をもつことが明らかにされた.
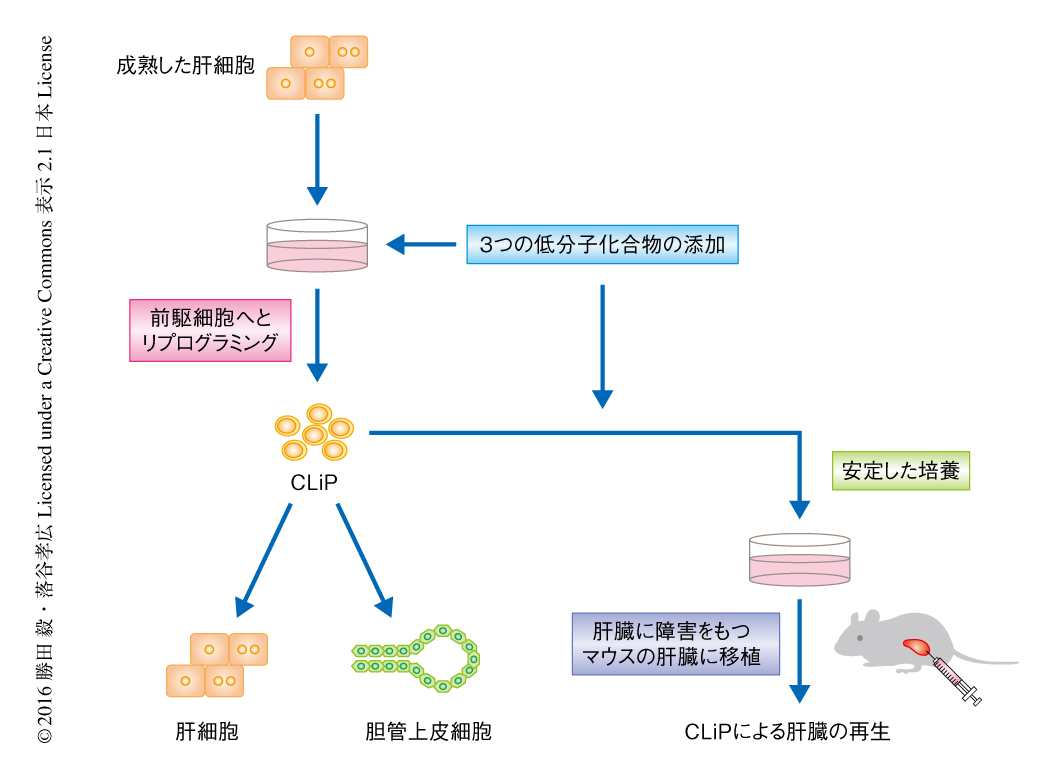
以上より,肝細胞は3つの低分子化合物の組合せの刺激により,増殖能および肝細胞と胆管上皮細胞への2方向の分化能をもつ肝前駆細胞へとリプログラミングされることが明らかにされた(図1).そこで,このリプログラミングされた前駆細胞をCLiP(chemically induced liver progenitor,化学的に誘導された肝前駆細胞)と命名した.さらに,同様の方法により,ラットだけでなくマウスの肝細胞からもCLiPを誘導できることが確かめられた.
CLiPが慢性的に障害にさらされた肝臓において再生能を発揮できるかどうか検討した.慢性肝炎をもつ免疫不全マウスにラットのCLiPを移植し,ラットのアルブミンの血中における濃度の推移をみたところ,移植ののち5週ごろまでは急激に増加し,そののち微増となり,移植ののち7~8週の時点ではほぼ一定の値になった.移植ののち8週の時点で肝臓を取り出してラットの細胞を染色したところ,マウスの肝臓の75~90%がラットの細胞に置換されていた.一方,摘出した肝臓のすべてにおいて腫瘍の形成は認められなかった.摘出した肝臓のラットの細胞がしめる領域においては,肝臓の機能にかかわる一連のタンパク質が発現していたことにくわえ,グリコーゲンも蓄積していた.さらに,ラットのCLiPにより置換されたマウスのキメラ肝臓からラットの細胞だけを採取しマイクロアレイ法により遺伝子の発現を解析した結果,ラットの肝臓から直接に採取した肝細胞ときわめて近い遺伝子発現プロファイルを示した.これらの結果から,移植されたCLiPはがん細胞のように無制限に増殖するわけではなく,生理的に意義のあるレベルにまで組織の修復を完了すると増殖を停止し,ホストの肝細胞に代わり肝臓として正常に機能することが強く示唆された(図1).以上より,肝臓の再生医療において,CLiPが安全かつ有用な細胞移植のソースになりうることが示された.
CLiPは肝細胞のなかのどのような集団に起源をもつのか検討した.すべての肝細胞がCLiPへとリプログラミングされるわけではなかったことから,CLiPへのリプログラミング能をもつ細胞は肝細胞のなかの限られた集団であることが予想された.一方で,この研究を進めていた最中,マウスの肝臓には増殖能のひときわ高い肝細胞が中心静脈の周囲に存在し,その細胞には2倍体のものが多く含まれるという論文が報告された4).通常の体細胞は2倍体であるのに対し,肝細胞には2倍体だけでなく4倍体以上の細胞も含まれ,しかも,マウスおよびラットにおいては85%もの肝細胞が4倍体以上であるとされている5).このことは古くから知られていたが,肝細胞の倍数性と表現型とのあいだの関係性についてはほとんどわかっていなかった.こうしたなか,この論文においてその関係性を示唆するデータが提示されたのである.
この報告をうけて,ラットの肝細胞における倍数性とCLiPへのリプログラミング能とのあいだに関係性があるのかどうか検討した.その結果,8倍体の肝細胞は増殖能をまったく獲得せず,増殖する細胞は2倍体および4倍体の肝細胞のみであることがわかった.さらに,増殖能についてより詳細に検討したところ,培養の開始から10日間で300個以上になる細胞は2倍体の肝細胞から限定的に誘導されていた.長期間にわたる培養ののちにはこのようないちじるしい増殖能をもつ細胞だけが選択されることを考えると,CLiPの起源は2倍体の肝細胞であると考えるのが妥当であろう.ラットを用いた実験において,肝細胞の全体のうち2倍体の肝細胞のしめる割合は約2~5%で,そのうち顕著なコロニー形成能を示した肝細胞の割合は約15%であったことから,単純に計算すると肝細胞の全体のおよそ0.3~0.8%という限られた集団がCLiPへのリプログラミング能をもつことになった.
この研究においてもっとも重要なポイントは,遺伝子組換えを施すことなく肝細胞を増殖性の肝前駆細胞へとリプログラミングすることができ,かつ,リプログラミングされた細胞はきわめて高い再生能をもつため将来的に再生医療への応用が期待できるという点である.
一方,この研究が肝臓の基礎的な研究にあたえる影響も意義深いと考えている.この研究に取り組んでいた2013年から2014年にかけて,肝臓の研究の流れを大きく左右する発見がなされた6-9).慢性障害を患う肝臓においては肝細胞の増殖能が低下して再生が不十分になり,症状の進行とともに胎児の肝芽細胞によく似た細胞(名称はさまざまだが,一般に,肝前駆細胞とよばれる)が増殖しはじめる.このような肝前駆細胞は正常時にはほとんどその存在が認められないことから,正常な肝臓においてその数はきわめて少なくかつ休眠状態にあり,慢性肝炎におちいった際にはじめて活性化されて再生に寄与する,いわば,切り札の細胞であると考えられてきた.ところが,最近の研究により,肝前駆細胞だと考えられていたこれらの細胞は,実際には休眠状態から活性化された細胞ではなく,成熟した肝細胞が変化した細胞であることが明らかにされた6-9).筆者らの研究は,この肝細胞のリプログラミングという現象を生体外で直接的に示したものであり,in vivoにおける発見に重要な裏づけをあたえたものであるといえる.さらに,遺伝子のノックダウンや強制発現,あるいは,さまざまなシグナル伝達経路の阻害により細胞におけるイベントを容易に制御できるというin vitroにおける実験系の利点を活かし,肝細胞のリプログラミング機構の解明を加速させられる可能性もある.実際,今回のin vitroにおける研究により見い出された,2倍体の肝細胞のみがCLiPへとリプログラミングされるという事実は,生体におけるリプログラミングの起源を探るうえでも重要な手がかりになるのではないかと期待している.
略歴:国立がん研究センター研究所 研究員
研究テーマ:肝細胞のリプログラミング,肝臓の発がんの機構.
落谷 孝広(Takahiro Ochiya)
国立がん研究センター研究所 主任分野長.
研究室URL:http://www.nccri.ncc.go.jp/s013/
© 2016 勝田 毅・落谷孝広 Licensed under CC 表示 2.1 日本
(国立がんセンター研究所 分子細胞治療研究分野)
email:落谷孝広
DOI: 10.7875/first.author.2016.123
Conversion of terminally committed hepatocytes to culturable bipotent progenitor cells with regenerative capacity.
Takeshi Katsuda, Masaki Kawamata, Keitaro Hagiwara, Ryou-u Takahashi, Yusuke Yamamoto, Fernando D. Camargo, Takahiro Ochiya
Cell Stem Cell, 20, 41-55 (2017)
要 約
肝臓の再生医療における重大な問題は,移植の可能な肝細胞あるいはその前駆細胞をin vitroにおいて増殖させ安定に供給するすべのないことである.筆者らは,この研究において,低分子化合物を用いてラットおよびマウスの肝細胞を肝細胞および胆管上皮細胞の両方への分化能をもつ肝前駆細胞へとリプログラミングできることを明らかにした.CLiPと命名されたこの肝前駆細胞は,増殖能を失うことなく,しかも,肝細胞への再分化能を維持した状態で長期間にわたり安定に培養することができた.さらには,ラットのCLiPを肝臓に重度の障害をもつ免疫不全マウスに移植したところ,がん化をともなうことなく障害された肝臓の75~90%が置換された.この成果は,肝臓の再生医療のあり方を一新しその実現に貢献する可能性がある.さらに,最近の報告から,慢性的に障害にさらされた肝臓において肝細胞が肝前駆細胞へとリプログラミングされることが明らかにされており,この研究は,この現象を理解するうえでも重要な知見になることが期待される.
はじめに
肝臓は唯一,再生能をもつことが知られている臓器であるが,慢性的に障害にさらされつづけるとその再生能は低下し,線維化や肝硬変へと進行して,最終的には肝がんがひき起こされる.現在のところ,このような重篤な肝疾患に対する治療法は肝臓の移植のみであるが,絶対的なドナーの不足が問題になっている.そのため,近年,多能性幹細胞から肝細胞を生体外で供給することが試みられている.しかし,多能性幹細胞から肝細胞へと分化させることはむずかしく,肝臓が障害された動物へ移植してもその再生能はきわめて低い.そのため,移植に使える肝細胞を生体外で安定に供給できる技術が強くもとめられている.
一方,肝臓のなかには肝細胞とよく似ているがそれよりも小さく機能的にやや未熟な小型肝細胞という名で知られる細胞の存在することが知られている1).小型肝細胞は通常の肝細胞とは異なり生体外でも増殖できることから肝細胞の供給源になりうるとの見方もある.しかし,その増殖能も一時的なものであり長期にわたり継代培養することはできない.
これまで,筆者らの研究室においては,4つの低分子化合物を用いることによりラットのES細胞をはじめさまざまな幹細胞および前駆細胞を安定に培養できることを明らかにしてきた2,3).そこで,小型肝細胞が実際に前駆細胞としての性質をもつのであれば,これらの低分子化合物を用いて安定に培養できるのではないかと考えた.
1.低分子化合物により肝細胞はin vitroにおいて増殖能を獲得する
小型肝細胞が生体外で増殖能を維持できるようになるかどうかを検討するため,4つの低分子化合物(Y-27632,PD0325901,A-83-01,CHIR99021)のすべての組合せを培養液に添加し,ラットから採取した小型肝細胞の増殖能を評価するというミニスクリーニングを実施した.この際,増殖する細胞が小型肝細胞であることを担保するため,陰性対照として成熟した肝細胞も同様の条件で培養した.その結果,小型肝細胞だけでなく成熟した肝細胞までもが複数の低分子化合物の組合せのもとで増殖した.とくに,ROCK阻害剤であるY-27632,TGFβ阻害剤であるA-83-01,GSK3阻害剤であるCHIR99021の3つの組合せを添加したときに肝細胞の増殖能はもっとも高くなり,2週間の培養により細胞の数は約30倍に増殖した.そこで,肝細胞からこの3つの低分子化合物の組合せにより誘導される増殖性の細胞に焦点をあてた.
2.増殖能を獲得した細胞は未分化な前駆細胞である
3つの低分子化合物の組合せにより誘導された増殖性の細胞は,形態的に明らかに肝細胞とは異なる細胞へと変化した.この細胞は肝細胞に比べ大きさは小さく,核と細胞質の比が高かった.このような形態は,肝細胞への運命づけがなされるまえの胎児の肝臓にみられる肝前駆細胞(肝芽細胞)に似ていた.実際に,免疫染色および遺伝子の発現解析により,この増殖性の細胞は一連の肝芽細胞のマーカーを発現していることが明らかにされ,成熟した肝細胞から前駆細胞の状態へと変化していることが強く示唆された.
この細胞が表現型としても前駆細胞へと変化しているかどうか検討した.発生の過程において内胚葉から分化した肝芽細胞は,増殖しながら肝臓のもとになる器官である肝芽を形成する.そして,周辺の環境からのシグナルに応じて肝芽の細胞はしだいに肝細胞あるいは胆管上皮細胞へと分化し,肝芽は肝臓へと成長する.これにならい,3つの低分子化合物の組合せにより誘導された増殖性の細胞がそうした2方向への分化能を示すかどうか検討した.肝芽の細胞を肝細胞へと成熟させるプロトコールを用いてこの増殖性の細胞を培養したところ,これらの細胞はすみやかに成熟した肝細胞様の形態へと変化し,薬物代謝やグリコーゲンの蓄積といった肝臓の機能を獲得した.一方,管腔構造の形成を促進する細胞外基質を含む培養液において培養したところ,この増殖性の細胞はネットワーク状の管腔構造を形成した.免疫染色および遺伝子の発現解析の結果,この管腔構造において胆管のマーカーの発現が確認された.さらに,この管腔構造を形成した細胞をセクレチンにより刺激したところ管腔の内部への水の輸送が促進され,また,胆汁を模倣した物質を添加したところ管腔の内部への胆汁の排泄が確かめられ,構築された管腔構造は機能的な胆管の性質をもつことが明らかにされた.
以上より,肝細胞は3つの低分子化合物の組合せの刺激により,増殖能および肝細胞と胆管上皮細胞への2方向の分化能をもつ肝前駆細胞へとリプログラミングされることが明らかにされた(図1).そこで,このリプログラミングされた前駆細胞をCLiP(chemically induced liver progenitor,化学的に誘導された肝前駆細胞)と命名した.さらに,同様の方法により,ラットだけでなくマウスの肝細胞からもCLiPを誘導できることが確かめられた.
3.CLiPは慢性的に障害にさらされた肝臓を高い効率で再生する
CLiPが慢性的に障害にさらされた肝臓において再生能を発揮できるかどうか検討した.慢性肝炎をもつ免疫不全マウスにラットのCLiPを移植し,ラットのアルブミンの血中における濃度の推移をみたところ,移植ののち5週ごろまでは急激に増加し,そののち微増となり,移植ののち7~8週の時点ではほぼ一定の値になった.移植ののち8週の時点で肝臓を取り出してラットの細胞を染色したところ,マウスの肝臓の75~90%がラットの細胞に置換されていた.一方,摘出した肝臓のすべてにおいて腫瘍の形成は認められなかった.摘出した肝臓のラットの細胞がしめる領域においては,肝臓の機能にかかわる一連のタンパク質が発現していたことにくわえ,グリコーゲンも蓄積していた.さらに,ラットのCLiPにより置換されたマウスのキメラ肝臓からラットの細胞だけを採取しマイクロアレイ法により遺伝子の発現を解析した結果,ラットの肝臓から直接に採取した肝細胞ときわめて近い遺伝子発現プロファイルを示した.これらの結果から,移植されたCLiPはがん細胞のように無制限に増殖するわけではなく,生理的に意義のあるレベルにまで組織の修復を完了すると増殖を停止し,ホストの肝細胞に代わり肝臓として正常に機能することが強く示唆された(図1).以上より,肝臓の再生医療において,CLiPが安全かつ有用な細胞移植のソースになりうることが示された.
4.CLiPは2倍体の肝細胞に由来する
CLiPは肝細胞のなかのどのような集団に起源をもつのか検討した.すべての肝細胞がCLiPへとリプログラミングされるわけではなかったことから,CLiPへのリプログラミング能をもつ細胞は肝細胞のなかの限られた集団であることが予想された.一方で,この研究を進めていた最中,マウスの肝臓には増殖能のひときわ高い肝細胞が中心静脈の周囲に存在し,その細胞には2倍体のものが多く含まれるという論文が報告された4).通常の体細胞は2倍体であるのに対し,肝細胞には2倍体だけでなく4倍体以上の細胞も含まれ,しかも,マウスおよびラットにおいては85%もの肝細胞が4倍体以上であるとされている5).このことは古くから知られていたが,肝細胞の倍数性と表現型とのあいだの関係性についてはほとんどわかっていなかった.こうしたなか,この論文においてその関係性を示唆するデータが提示されたのである.
この報告をうけて,ラットの肝細胞における倍数性とCLiPへのリプログラミング能とのあいだに関係性があるのかどうか検討した.その結果,8倍体の肝細胞は増殖能をまったく獲得せず,増殖する細胞は2倍体および4倍体の肝細胞のみであることがわかった.さらに,増殖能についてより詳細に検討したところ,培養の開始から10日間で300個以上になる細胞は2倍体の肝細胞から限定的に誘導されていた.長期間にわたる培養ののちにはこのようないちじるしい増殖能をもつ細胞だけが選択されることを考えると,CLiPの起源は2倍体の肝細胞であると考えるのが妥当であろう.ラットを用いた実験において,肝細胞の全体のうち2倍体の肝細胞のしめる割合は約2~5%で,そのうち顕著なコロニー形成能を示した肝細胞の割合は約15%であったことから,単純に計算すると肝細胞の全体のおよそ0.3~0.8%という限られた集団がCLiPへのリプログラミング能をもつことになった.
おわりに
この研究においてもっとも重要なポイントは,遺伝子組換えを施すことなく肝細胞を増殖性の肝前駆細胞へとリプログラミングすることができ,かつ,リプログラミングされた細胞はきわめて高い再生能をもつため将来的に再生医療への応用が期待できるという点である.
一方,この研究が肝臓の基礎的な研究にあたえる影響も意義深いと考えている.この研究に取り組んでいた2013年から2014年にかけて,肝臓の研究の流れを大きく左右する発見がなされた6-9).慢性障害を患う肝臓においては肝細胞の増殖能が低下して再生が不十分になり,症状の進行とともに胎児の肝芽細胞によく似た細胞(名称はさまざまだが,一般に,肝前駆細胞とよばれる)が増殖しはじめる.このような肝前駆細胞は正常時にはほとんどその存在が認められないことから,正常な肝臓においてその数はきわめて少なくかつ休眠状態にあり,慢性肝炎におちいった際にはじめて活性化されて再生に寄与する,いわば,切り札の細胞であると考えられてきた.ところが,最近の研究により,肝前駆細胞だと考えられていたこれらの細胞は,実際には休眠状態から活性化された細胞ではなく,成熟した肝細胞が変化した細胞であることが明らかにされた6-9).筆者らの研究は,この肝細胞のリプログラミングという現象を生体外で直接的に示したものであり,in vivoにおける発見に重要な裏づけをあたえたものであるといえる.さらに,遺伝子のノックダウンや強制発現,あるいは,さまざまなシグナル伝達経路の阻害により細胞におけるイベントを容易に制御できるというin vitroにおける実験系の利点を活かし,肝細胞のリプログラミング機構の解明を加速させられる可能性もある.実際,今回のin vitroにおける研究により見い出された,2倍体の肝細胞のみがCLiPへとリプログラミングされるという事実は,生体におけるリプログラミングの起源を探るうえでも重要な手がかりになるのではないかと期待している.
文 献
- Chen, Q., Kon, J., Ooe, H. et al.: Selective proliferation of rat hepatocyte progenitor cells in serum-free culture. Nat. Protoc., 2, 1197-1205 (2007)[PubMed]
- Kawamata, M. & Ochiya, T.: Generation of genetically modified rats from embryonic stem cells. Proc. Natl. Acad. Sci. USA, 107, 14223-14228 (2010)[PubMed]
- Kawamata, M., Katsuda, T., Yamada, Y. et al.: In vitro reconstitution of breast cancer heterogeneity with multipotent cancer stem cells using small molecules. Biochem. Biophys. Res. Commun., 482, 750-757 (2017)[PubMed]
- Wang, B., Zhao, L., Fish, M. et al.: Self-renewing diploid Axin2+ cells fuel homeostatic renewal of the liver. Nature, 524, 180-185 (2015)[PubMed]
- Gentric, G. & Desdouets, C.: Polyploidization in liver tissue. Am. J. Pathol., 184, 322-331 (2014)[PubMed]
- Yanger, K., Zong, Y., Maggs, L. R. et al.: Robust cellular reprogramming occurs spontaneously during liver regeneration. Genes Dev., 27, 719-724 (2013)[PubMed]
- Tanimizu, N,, Nishikawa, Y., Ichinohe, N. et al.: Sry HMG box protein 9-positive (Sox9+) epithelial cell adhesion molecule-negative (EpCAM-) biphenotypic cells derived from hepatocytes are involved in mouse liver regeneration. J. Biol. Chem., 289, 7589-7598 (2014)[PubMed]
- Tarlow, B. D., Pelz, C., Naugler, W. E. et al.: Bipotential adult liver progenitors are derived from chronically injured mature hepatocytes. Cell Stem Cell, 15, 605-618 (2014)[PubMed]
- Yimlamai, D., Christodoulou, C., Galli, G. G. et al.: Hippo pathway activity influences liver cell fate. Cell, 157, 1324-1338 (2014)[PubMed]
活用したデータベースにかかわるキーワードと統合TVへのリンク
著者プロフィール
略歴:国立がん研究センター研究所 研究員
研究テーマ:肝細胞のリプログラミング,肝臓の発がんの機構.
落谷 孝広(Takahiro Ochiya)
国立がん研究センター研究所 主任分野長.
研究室URL:http://www.nccri.ncc.go.jp/s013/
© 2016 勝田 毅・落谷孝広 Licensed under CC 表示 2.1 日本