試験管内におけるRNA粒子の形成
加藤昌人・Steven L. McKnight
(米国Texas大学Southwestern Medical Center,Department of Biochemistry)
email:加藤昌人
DOI: 10.7875/first.author.2012.063
Cell-free formation of RNA granules: low complexity sequence domains form dynamic fibers within hydrogels.
Masato Kato, Tina W. Han, Shanhai Xie, Kevin Shi, Xinlin Du, Leeju C. Wu, Hamid Mirzaei, Elizabeth J. Goldsmith, Jamie Longgood, Jimin Pei, Nick V. Grishin, Douglas E. Frantz, Jay W. Schneider, She Chen, Lin Li, Michael R. Sawaya, David Eisenberg, Robert Tycko, Steven L. McKnight
Cell, 149, 753-767 (2012)
真核生物の細胞にはRNA粒子とよばれるRNAとタンパク質との凝集体が形成されている.この凝集体に含まれるタンパク質の多くはRNA結合タンパク質であり,RNA結合ドメインを含むと同時に,機能のわかっていないLC配列とよばれる領域をもつ.筆者らは,ビオチン化したイソオキサゾール化合物を細胞抽出液や組織抽出液にくわえると,RNA粒子に含まれるタンパク質が特異的に沈殿することを発見した.この沈殿の形成には,これらのタンパク質に含まれるLC配列が必要十分であった.また,RNA粒子に含まれるタンパク質であるFUSおよびhnRNPA2のもつLC配列は,ビオチン化イソオキサゾール化合物とは関係なく可逆性のアミロイド様の線維を形成し,その濃度に依存しヒドロゲル状態に相転移することを見い出した.このヒドロゲルは,あたかもRNA粒子のように,RNA粒子に含まれるほかのタンパク質のLC配列をその内部に蓄積した.これらの結果は,これまで長らく解明できなかった2つの問題,すなわち,多くのタンパク質に含まれるLC配列の本来もつ生理学的な機能と,RNA粒子をはじめCajal体や核スペックルなど膜をもたない構造体の形成機構について,はじめて分子レベルでの具体的な知見をあたえた.
真核生物の細胞において観察されるRNA粒子(RNA granule)は,おもにmRNAとRNA結合タンパク質から構成される膜をもたない凝集体である.RNA粒子には,生殖細胞にみられるgerm granuleやpolar granule,体細胞にみられるstress granuleやPボディ(processing body),ニューロンに存在するneuronal granuleなどが知られている1).これらのRNA粒子はmRNAの輸送,局在化,貯蔵,分解などを行い,細胞の状況に応じ遺伝子発現の全体を制御することがその役割であると,これまで精力的に行われてきた細胞生物学的な研究から明らかになっている.しかしながら,RNA粒子は非常にダイナミックな凝集体であるため細胞からの精製が困難であり,その形成のしくみや内部の構造など生化学的あるいは構造学的な研究はいままでまったくできなかった.RNA粒子の典型的な構成タンパク質であるRNA結合タンパク質の多くはRNA結合ドメインとLC(low-complexity)配列とよばれる配列をもっている.LC配列はアミノ酸残基の種類が著しくかたよった配列であり,多くの場合,決まった構造をもたずフレキシブルな状態をとっている.また,溶解度の低いこと,および,プロテアーゼにより分解されやすいことから,これまで研究の対象となりづらかった.そのため,LC配列はRNA粒子に含まれるタンパク質のみならず,ほかの多くのタンパク質にも存在することがわかっていたものの,その生物学的な機能はよくわかっていない2).筆者らは,低分子化合物による沈殿とヒドロゲル化という,RNA粒子の状態をin vitroにおいて再現できる2つの方法を発見し,LC配列がRNA粒子の形成に重要なはたらきをしていることを明らかにすることで,これまで得体のしれなかったLC配列の本来の生物学的な機能について基本的な原理を提唱した.
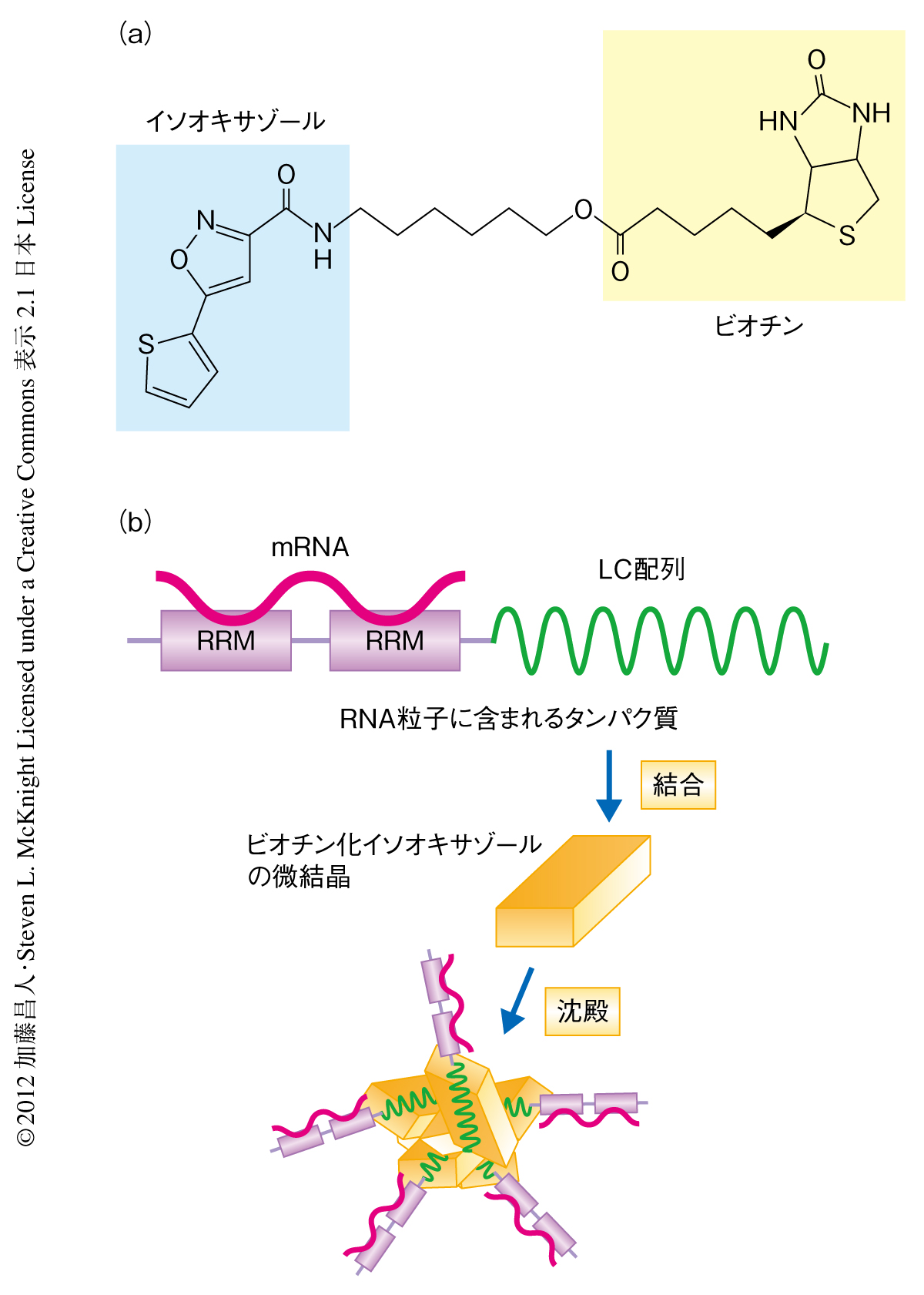
イソオキサゾール化合物(図1a)は,マウスのES細胞を心筋細胞に分化誘導する化合物としてスクリーニングされた3).筆者らは,イソオキサゾール化合物の標的タンパク質を同定するため,ビオチン化したイソオキサゾール化合物を合成しマウスの細胞抽出液に混ぜ,アビジンビーズによりこれに特異的に結合するタンパク質を分離することを試みた.しかしながら,SDS-ポリアクリルアミドゲル電気泳動の結果,アビジンビーズ画分には数百ものタンパク質のバンドが検出され,標的タンパク質の同定という目的はまったくの失敗に終わった.ところが,この電気泳動の結果をよく観察してみたところ,アビジンビーズの分離ののち上清に残ったタンパク質のバンドのパターンは,分離のまえの細胞抽出液のバンドのパターンとまったく変わらないことに気づいた.つまり,アビジンビーズにより分離されてくるのは細胞抽出液のなかでもまれなタンパク質であること,また,対照実験により,アビジンビーズがなくてもビオチン化イソオキサゾール化合物だけで同じタンパク質が沈殿することもわかった.これらの結果から,ビオチン化イソオキサゾール化合物は水溶液に混ざるとそれ自体が不溶化し,それと同時に,細胞抽出液に含まれているまれなタンパク質を共沈させるのだろうと推察された(図1b).
では,いったいどのようなタンパク質がビオチン化イソオキサゾール化合物により沈殿するのであろうか? 質量分析により同定したところ,そのほとんどがRNA結合タンパク質やDEADボックスヘリカーゼなどRNAに関連するタンパク質であった.さらに,その大半はRNA粒子に含まれるタンパク質であることがわかった.統計的な計算から,ビオチン化イソオキサゾール化合物により沈殿するタンパク質とRNA粒子に含まれるタンパク質との重なりにおいてp < 0.0001(有意ではない確率は0.0001以下)であり,ビオチン化イソオキサゾール化合物にはRNA粒子に含まれるタンパク質を特異的に沈殿させる作用があるものと結論づけた.また,この沈殿は37度に温めると可溶化され,4度にもどすと再び沈殿することから,この沈殿の形成は可逆的であることがわかった.さらに,多くのRNA結合タンパク質に含まれるLC配列が,ビオチン化イソオキサゾール化合物による沈殿に必要十分であることもわかった.統計的な計算から,LC配列を含むタンパク質の頻度は,ビオチン化イソオキサゾール化合物により沈殿するタンパク質,および,RNA粒子に含まれるタンパク質において,ともに,マウスの全タンパク質に比べ4倍も高いことがわかった.
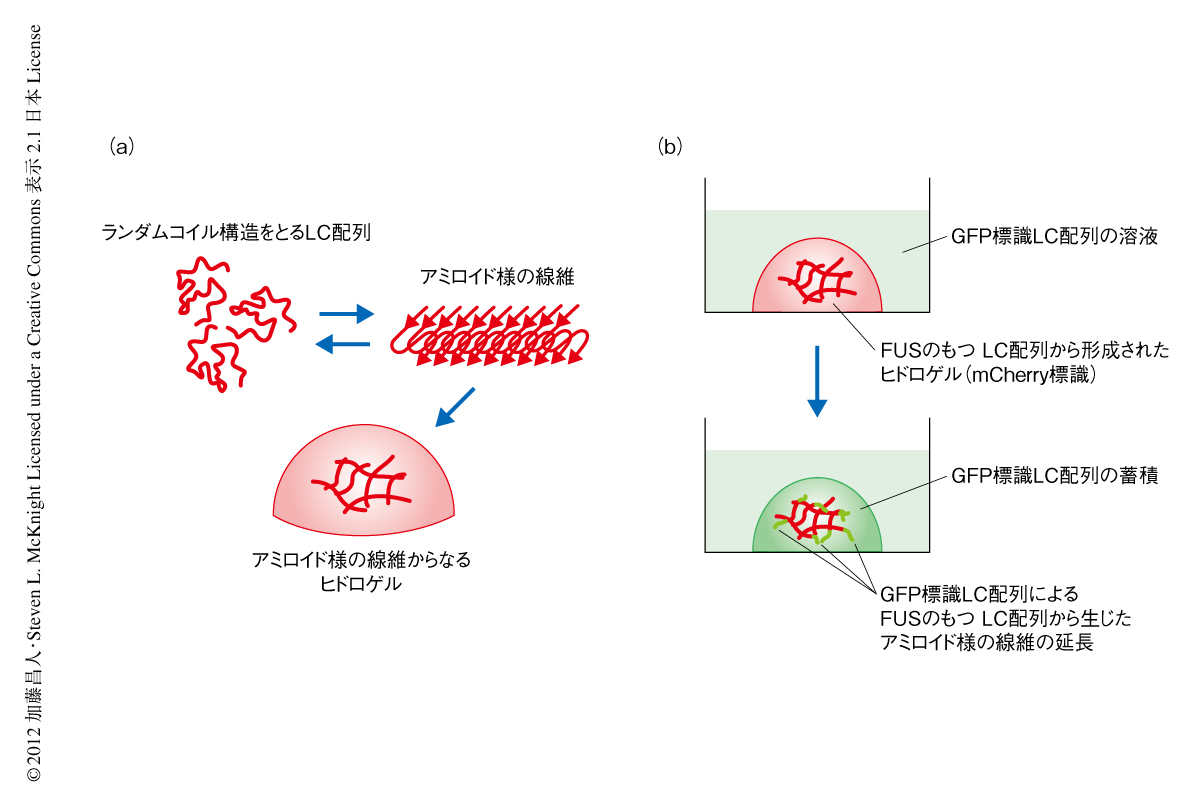
RNA結合タンパク質であるFUSとhnRNPA2はRNA粒子に含まれ,ビオチン化イソオキサゾール化合物により沈殿した.これら2つのタンパク質のもつLC配列は20 mg/ml以上の高濃度の状態になるとヒドロゲル化することが見い出された(図2a).このヒドロゲル化にはビオチン化イソオキサゾール化合物はまったく必要なく,以降,ヒドロゲルを用いた実験にはとくに記述した場合を除きビオチン化イソオキサゾール化合物は関係していない.RNA粒子の正体はこのようなタンパク質からなるヒドロゲルなのではないかと仮定し,以下のようなヒドロゲルとの結合実験を行った.まず,FUSあるいはhnRNPA2のもつLC配列を蛍光タンパク質mCherryに融合させた組換えタンパク質として精製した.これらmCherryにより標識したLC配列を高濃縮し,顕微鏡用のディッシュのなかにヒドロゲルからなる0.5μlの小さなドロップを作製した.一方,RNA粒子に含まれるほかのタンパク質のLC配列を別の蛍光タンパク質GFPに融合させた組換えタンパク質として精製し,1μMの濃度でこのドロップが浸るようディッシュに注いだ.数日のあいだ静置したのち,共焦点レーザー顕微鏡によりヒドロゲルからなるドロップの断面のmCherryとGFPのシグナルをスキャンした.その結果,すべてのGFP標識LC配列がヒドロゲルの内部に蓄積していることが確認された(図2b).LC配列をもたないGFPだけのときには蓄積はまったくみられず,また,LC配列以外の配列をGFP標識して用いたときにも蓄積はみられなかった.このことより,FUSあるいはhnRNPA2のもつLC配列から形成されるヒドロゲルは,RNA粒子に含まれるほかのタンパク質のもつLC配列と特異的に結合して蓄積することがわかった.
FUSのもつLC配列には27個のチロシン残基があり,そのほとんどはグリシン残基またはセリン残基によりはさまれていて,これを[GS]Y[GS]モチーフと名づけた.この[GS]Y[GS]モチーフがヒドロゲルの形成にどのように影響しているか調べるため,FUSのもつLC配列について,5個,9個,15個,27個すべて,と異なる数のチロシン残基をセリン残基へと置換した変異体を作製した.これらのLC配列変異体はすべて,高濃度に濃縮してもヒドロゲルを形成しなかった.つぎに,これらLC配列変異体がFUCのもつLC配列から形成されたヒドロゲルに結合するかどうかを調べた.その結果,変異の数が増えるにつれヒドロゲルへの蓄積度は下がっていき,15個あるいは27個すべてのチロシン残基を置換したLC配列変異体はヒドロゲルにまったく蓄積しなかった.同じ変異をもつFUSをU2OS細胞にトランスフェクションし,これらの変異体がRNA粒子の一種であるstress granuleに蓄積するかどうかを調べた.さきのヒドロゲルとの結合実験と同様に,変異の数が増えるにしたがいstress granuleへの蓄積度は下がり,15個あるいは27個すべてのチロシン残基を置換したFUS変異体はstress granuleにまったく蓄積しなかった.これらの結果より,ヒドロゲルはRNA粒子と同様の性質をもっていることが明らかになった.この[GS]Y[GS]モチーフを多くもつタンパク質の数を,ビオチン化イソオキサゾール化合物により沈殿するタンパク質,および,RNA粒子に含まれるタンパク質において調べてみると,マウスの全タンパク質に比べ,前者で15倍,後者で8倍も多いことがわかった.
では,このヒドロゲルはいったいどのように形成されているのであろうか? ヒドロゲルの構造を顕微鏡とX線散乱により調べてみると,アミロイド線維に特有のクロスβ構造をもつアミロイド様の線維が寄り集まってできていることがわかった.これまで知られている病原性のアミロイド線維の特徴は,不可逆的に形成され非常に安定なことである4).一方,FUSあるいはhnRNPA2のもつLC配列から生じたアミロイド様の線維の安定性をみるため,強力な界面活性剤であるSDSに対する抵抗性をSDD-アガロースゲル電気泳動(semi-denaturing detargent agarose gel electrophoresis:SDD-AGE)法により調べたところ,FUSあるいはhnRNPA2のもつLC配列から生じたアミロイド様の線維はSDSが0%の緩衝液に希釈するだけでほぼ完全に解離した.一方,アミロイド線維の代表例として用いた出芽酵母Sup35から構成された線維は5),2%のSDSにおいてもほとんど解離せず残った.よって,形態的にはよく似ていても,FUSあるいはhnRNPA2のもつLC配列から生じたアミロイド様の線維は,病原性の不可逆なアミロイド線維とは根本的に異なっていることがわかった.
LC配列から形成されるヒドロゲルはアミロイド様の線維の凝集体であることがわかったが,では,ほかのLC配列がヒドロゲルに蓄積するのはどのような機構によるのだろうか? FUSのもつLC配列(mCherryで標識)から生じたアミロイド様の線維を超音波により破砕し種となる細かい線維(シード)を作製して,この少量のシードを線維を形成していないFUSのもつLC配列(GFPで標識)の溶液に混ぜ,シードからの線維の成長を観察した.すると,mCherryで標識されたシードの両端から,GFPで標識された線維の成長するのが観察された.また,FUSのもつLC配列について異なった数のチロシン残基をセリン残基へと置換した変異体を用いた場合には,5個あるいは9個のチロシン残基を置換したLC配列変異体ではシードの成長が観察されたが,15個あるいは27個すべてのチロシン残基を置換したLC配列変異体ではシードの成長はまったく観察されなかった.これらは,さきのヒドロゲルとの結合実験およびstress granuleとの結合実験の結果と一致した.これらの結果より,FUSのもつLC配列から形成されたヒドロゲルに野生型および変異型のFUSのもつLC配列が蓄積するのは,FUSのもつLC配列がヒドロゲルを構成するアミロイド様の線維から延長して重合することによることがわかった.
さて,この場合は野生型にせよ変異体にせよ重合するのはシードと同じFUSのもつLC配列であり驚くべきことではない.ではRNA粒子に含まれるほかのタンパク質のもつLC配列の場合ではどうなのだろうか? 同じ実験をほかのいくつかのLC配列を用いて試みたところ,FUSのもつLC配列から生じたアミロイド様の線維から作製したシードから,hnRNPA1およびCIRBPのもつLC配列による線維の成長がみられた.また,hnRNAPA2のもつLC配列からなるシードからは,hnRNPA1およびRBM3のもつLC配列による線維の成長がみられた.すべての場合において,GFPにより標識されたLC配列による重合の部分に重なり,mCherryにより標識されたシードによる重合も観察された.おそらくこの部分では,シード溶液に残っていたmCherry標識LC配列とGFP標識LC配列とが共重合しながら線維を成長させているものと考えられた.このように,ヘテロなLC配列による場合でも,ヒドロゲルへの蓄積はシードからの線維の成長という分子機構により起こることが明らかになった.RNA粒子において異なるLC配列をもつタンパク質が集合するのも,このようなヘテロな共重合による線維の形成が起こっているからだと推察された.
ビオチン化イソオキサゾール化合物がLC配列をもつタンパク質を特異的に沈殿させる分子機構を明らかにするため,まず,そのタンパク質の沈殿を顕微鏡により観察したところ,針状の微結晶からなる巨大な凝集体が観察された.この凝集体にエチジウムブロミドをくわえると,エチジウムブロミドに特有の波長で蛍光が観測された.細胞抽出液を含まない緩衝液にビオチン化イソオキサゾール化合物を混ぜたときにも同じような針状の微結晶が観察された.しかしこのとき,微結晶は小さなクラスターとして存在し,細胞抽出液において生じるような大きな凝集体ではなかった.また,この微結晶はエチジウムブロミドをくわえてもその蛍光は観測されなかった.以上のことより,ビオチン化イソオキサゾール化合物はそれ自体が水溶液中で微結晶化し,その微結晶がRNA粒子に含まれるLC配列をもつタンパク質(および,それらに結合した核酸)を特異的に吸着し,巨大な凝集体となり沈殿することがわかった(図1b).
では,ビオチン化イソオキサゾール化合物の微結晶はLC配列をもつタンパク質をどのように吸着するのであろうか? その謎を解くため,ビオチン化イソオキサゾール化合物のX線結晶構造を決定した.微結晶は細胞抽出液と同じ緩衝液を用いマクロシーディング法によりX線回折実験に適した大きさにまで成長させた.構造決定の結果,ビオチン化イソオキサゾール化合物の分子は伸びきった状態で非対称単位内の隣接する分子と結合し,結晶の内部ではそれぞれの分子が層状に入れ替わりに配列していた.その結果,結晶の表面では隣接した層が凸凹状になり長い溝を形成することが可能であることがわかった.この凸凹の距離はβストランド構造をとる1本のポリペプチドがちょうどはまり込むことのできる4.7Åであった.構造をもたないランダムコイル状のLC配列がこの溝にふれるとβストランド構造に変化し結合するものと考えられた.球状の構造をもつタンパク質には溝にはまってβストランド構造に変化するほど十分に長いフレキシブルな領域をもたないため,結晶の表面には結合できないのだろう.最後に,ビオチン化イソオキサゾール化合物によるタンパク質の沈殿が温度に依存して可逆的なのは,微結晶は37度に温めると溶解し結合していたLC配列がランダムコイル構造にもどるからだと考えられた.
今回の研究より,筆者らは,これまで生物学的な機能が不明であったLC配列が,溶解状態からアミロイド様の線維へと可逆的に転換できることを見い出した.また,この可逆性のアミロイド様の線維は,膜をもたない凝集体であるRNA粒子の構造の基礎である可能性を示した.また,可逆性のアミロイド様の線維が異なるLC配列により共重合することで,多くのタンパク質がダイナミックに出入りするRNA粒子の形成されている可能性を示唆した.
この論文と同時に発表した付随論文では6),ビオチン化イソオキサゾール化合物による沈殿に含まれるRNAをRNAseq法により同定し,これまでRNA粒子に集合することが報告されていたすべてのmRNAが,ビオチン化イソオキサゾール化合物による沈殿に取り込まれることを確認し報告した.また,FUSのもつLC配列から形成されるヒドロゲルに結合するRNAを細胞抽出液から捕捉し同定したところ,ビオチン化イソオキサゾール化合物による沈殿に含まれるmRNAとほとんど同じmRNAがヒドロゲルに結合することを示した.ビオチン化イソオキサゾール化合物による沈殿とLC配列から形成されるヒドロゲルの両方とも,RNA粒子に含まれるタンパク質およびmRNAを正確に捕捉することができたことから,今後,これらの方法を用いたRNA粒子の生化学的な研究の促進されることが期待される.
略歴:1998年 奈良先端科学技術大学院大学バイオサイエンス研究科にて博士号取得,米国Harvard Medical School研究員を経て,米国Texas大学Southwestern Medical CenterにてAssistant Professor.
研究テーマ:可逆性のアミロイド様の線維の生物学的な機能と構造.
Steven L. McKnight
米国Texas大学Southwestern Medical CenterにてProfessor.
研究室URL:http://www4.utsouthwestern.edu/mcknightlab/
© 2012 加藤昌人・Steven L. McKnight Licensed under CC 表示 2.1 日本
(米国Texas大学Southwestern Medical Center,Department of Biochemistry)
email:加藤昌人
DOI: 10.7875/first.author.2012.063
Cell-free formation of RNA granules: low complexity sequence domains form dynamic fibers within hydrogels.
Masato Kato, Tina W. Han, Shanhai Xie, Kevin Shi, Xinlin Du, Leeju C. Wu, Hamid Mirzaei, Elizabeth J. Goldsmith, Jamie Longgood, Jimin Pei, Nick V. Grishin, Douglas E. Frantz, Jay W. Schneider, She Chen, Lin Li, Michael R. Sawaya, David Eisenberg, Robert Tycko, Steven L. McKnight
Cell, 149, 753-767 (2012)
要 約
真核生物の細胞にはRNA粒子とよばれるRNAとタンパク質との凝集体が形成されている.この凝集体に含まれるタンパク質の多くはRNA結合タンパク質であり,RNA結合ドメインを含むと同時に,機能のわかっていないLC配列とよばれる領域をもつ.筆者らは,ビオチン化したイソオキサゾール化合物を細胞抽出液や組織抽出液にくわえると,RNA粒子に含まれるタンパク質が特異的に沈殿することを発見した.この沈殿の形成には,これらのタンパク質に含まれるLC配列が必要十分であった.また,RNA粒子に含まれるタンパク質であるFUSおよびhnRNPA2のもつLC配列は,ビオチン化イソオキサゾール化合物とは関係なく可逆性のアミロイド様の線維を形成し,その濃度に依存しヒドロゲル状態に相転移することを見い出した.このヒドロゲルは,あたかもRNA粒子のように,RNA粒子に含まれるほかのタンパク質のLC配列をその内部に蓄積した.これらの結果は,これまで長らく解明できなかった2つの問題,すなわち,多くのタンパク質に含まれるLC配列の本来もつ生理学的な機能と,RNA粒子をはじめCajal体や核スペックルなど膜をもたない構造体の形成機構について,はじめて分子レベルでの具体的な知見をあたえた.
はじめに
真核生物の細胞において観察されるRNA粒子(RNA granule)は,おもにmRNAとRNA結合タンパク質から構成される膜をもたない凝集体である.RNA粒子には,生殖細胞にみられるgerm granuleやpolar granule,体細胞にみられるstress granuleやPボディ(processing body),ニューロンに存在するneuronal granuleなどが知られている1).これらのRNA粒子はmRNAの輸送,局在化,貯蔵,分解などを行い,細胞の状況に応じ遺伝子発現の全体を制御することがその役割であると,これまで精力的に行われてきた細胞生物学的な研究から明らかになっている.しかしながら,RNA粒子は非常にダイナミックな凝集体であるため細胞からの精製が困難であり,その形成のしくみや内部の構造など生化学的あるいは構造学的な研究はいままでまったくできなかった.RNA粒子の典型的な構成タンパク質であるRNA結合タンパク質の多くはRNA結合ドメインとLC(low-complexity)配列とよばれる配列をもっている.LC配列はアミノ酸残基の種類が著しくかたよった配列であり,多くの場合,決まった構造をもたずフレキシブルな状態をとっている.また,溶解度の低いこと,および,プロテアーゼにより分解されやすいことから,これまで研究の対象となりづらかった.そのため,LC配列はRNA粒子に含まれるタンパク質のみならず,ほかの多くのタンパク質にも存在することがわかっていたものの,その生物学的な機能はよくわかっていない2).筆者らは,低分子化合物による沈殿とヒドロゲル化という,RNA粒子の状態をin vitroにおいて再現できる2つの方法を発見し,LC配列がRNA粒子の形成に重要なはたらきをしていることを明らかにすることで,これまで得体のしれなかったLC配列の本来の生物学的な機能について基本的な原理を提唱した.
1.イソオキサゾール化合物はRNA粒子に含まれるタンパク質を特異的かつ可逆的に沈殿させる
イソオキサゾール化合物(図1a)は,マウスのES細胞を心筋細胞に分化誘導する化合物としてスクリーニングされた3).筆者らは,イソオキサゾール化合物の標的タンパク質を同定するため,ビオチン化したイソオキサゾール化合物を合成しマウスの細胞抽出液に混ぜ,アビジンビーズによりこれに特異的に結合するタンパク質を分離することを試みた.しかしながら,SDS-ポリアクリルアミドゲル電気泳動の結果,アビジンビーズ画分には数百ものタンパク質のバンドが検出され,標的タンパク質の同定という目的はまったくの失敗に終わった.ところが,この電気泳動の結果をよく観察してみたところ,アビジンビーズの分離ののち上清に残ったタンパク質のバンドのパターンは,分離のまえの細胞抽出液のバンドのパターンとまったく変わらないことに気づいた.つまり,アビジンビーズにより分離されてくるのは細胞抽出液のなかでもまれなタンパク質であること,また,対照実験により,アビジンビーズがなくてもビオチン化イソオキサゾール化合物だけで同じタンパク質が沈殿することもわかった.これらの結果から,ビオチン化イソオキサゾール化合物は水溶液に混ざるとそれ自体が不溶化し,それと同時に,細胞抽出液に含まれているまれなタンパク質を共沈させるのだろうと推察された(図1b).
では,いったいどのようなタンパク質がビオチン化イソオキサゾール化合物により沈殿するのであろうか? 質量分析により同定したところ,そのほとんどがRNA結合タンパク質やDEADボックスヘリカーゼなどRNAに関連するタンパク質であった.さらに,その大半はRNA粒子に含まれるタンパク質であることがわかった.統計的な計算から,ビオチン化イソオキサゾール化合物により沈殿するタンパク質とRNA粒子に含まれるタンパク質との重なりにおいてp < 0.0001(有意ではない確率は0.0001以下)であり,ビオチン化イソオキサゾール化合物にはRNA粒子に含まれるタンパク質を特異的に沈殿させる作用があるものと結論づけた.また,この沈殿は37度に温めると可溶化され,4度にもどすと再び沈殿することから,この沈殿の形成は可逆的であることがわかった.さらに,多くのRNA結合タンパク質に含まれるLC配列が,ビオチン化イソオキサゾール化合物による沈殿に必要十分であることもわかった.統計的な計算から,LC配列を含むタンパク質の頻度は,ビオチン化イソオキサゾール化合物により沈殿するタンパク質,および,RNA粒子に含まれるタンパク質において,ともに,マウスの全タンパク質に比べ4倍も高いことがわかった.
2.FUSあるいはhnRNPA2のもつLC配列は濃度に依存的に相転移してヒドロゲルを形成しほかのタンパク質のもつLC配列と結合する
RNA結合タンパク質であるFUSとhnRNPA2はRNA粒子に含まれ,ビオチン化イソオキサゾール化合物により沈殿した.これら2つのタンパク質のもつLC配列は20 mg/ml以上の高濃度の状態になるとヒドロゲル化することが見い出された(図2a).このヒドロゲル化にはビオチン化イソオキサゾール化合物はまったく必要なく,以降,ヒドロゲルを用いた実験にはとくに記述した場合を除きビオチン化イソオキサゾール化合物は関係していない.RNA粒子の正体はこのようなタンパク質からなるヒドロゲルなのではないかと仮定し,以下のようなヒドロゲルとの結合実験を行った.まず,FUSあるいはhnRNPA2のもつLC配列を蛍光タンパク質mCherryに融合させた組換えタンパク質として精製した.これらmCherryにより標識したLC配列を高濃縮し,顕微鏡用のディッシュのなかにヒドロゲルからなる0.5μlの小さなドロップを作製した.一方,RNA粒子に含まれるほかのタンパク質のLC配列を別の蛍光タンパク質GFPに融合させた組換えタンパク質として精製し,1μMの濃度でこのドロップが浸るようディッシュに注いだ.数日のあいだ静置したのち,共焦点レーザー顕微鏡によりヒドロゲルからなるドロップの断面のmCherryとGFPのシグナルをスキャンした.その結果,すべてのGFP標識LC配列がヒドロゲルの内部に蓄積していることが確認された(図2b).LC配列をもたないGFPだけのときには蓄積はまったくみられず,また,LC配列以外の配列をGFP標識して用いたときにも蓄積はみられなかった.このことより,FUSあるいはhnRNPA2のもつLC配列から形成されるヒドロゲルは,RNA粒子に含まれるほかのタンパク質のもつLC配列と特異的に結合して蓄積することがわかった.
3.[GS]Y[GS]モチーフのチロシン残基がヒドロゲルの形成に必要である
FUSのもつLC配列には27個のチロシン残基があり,そのほとんどはグリシン残基またはセリン残基によりはさまれていて,これを[GS]Y[GS]モチーフと名づけた.この[GS]Y[GS]モチーフがヒドロゲルの形成にどのように影響しているか調べるため,FUSのもつLC配列について,5個,9個,15個,27個すべて,と異なる数のチロシン残基をセリン残基へと置換した変異体を作製した.これらのLC配列変異体はすべて,高濃度に濃縮してもヒドロゲルを形成しなかった.つぎに,これらLC配列変異体がFUCのもつLC配列から形成されたヒドロゲルに結合するかどうかを調べた.その結果,変異の数が増えるにつれヒドロゲルへの蓄積度は下がっていき,15個あるいは27個すべてのチロシン残基を置換したLC配列変異体はヒドロゲルにまったく蓄積しなかった.同じ変異をもつFUSをU2OS細胞にトランスフェクションし,これらの変異体がRNA粒子の一種であるstress granuleに蓄積するかどうかを調べた.さきのヒドロゲルとの結合実験と同様に,変異の数が増えるにしたがいstress granuleへの蓄積度は下がり,15個あるいは27個すべてのチロシン残基を置換したFUS変異体はstress granuleにまったく蓄積しなかった.これらの結果より,ヒドロゲルはRNA粒子と同様の性質をもっていることが明らかになった.この[GS]Y[GS]モチーフを多くもつタンパク質の数を,ビオチン化イソオキサゾール化合物により沈殿するタンパク質,および,RNA粒子に含まれるタンパク質において調べてみると,マウスの全タンパク質に比べ,前者で15倍,後者で8倍も多いことがわかった.
4.FUSあるいはhnRNPA2のもつLC配列から形成されるヒドロゲルは可逆性のアミロイド様の線維でできている
では,このヒドロゲルはいったいどのように形成されているのであろうか? ヒドロゲルの構造を顕微鏡とX線散乱により調べてみると,アミロイド線維に特有のクロスβ構造をもつアミロイド様の線維が寄り集まってできていることがわかった.これまで知られている病原性のアミロイド線維の特徴は,不可逆的に形成され非常に安定なことである4).一方,FUSあるいはhnRNPA2のもつLC配列から生じたアミロイド様の線維の安定性をみるため,強力な界面活性剤であるSDSに対する抵抗性をSDD-アガロースゲル電気泳動(semi-denaturing detargent agarose gel electrophoresis:SDD-AGE)法により調べたところ,FUSあるいはhnRNPA2のもつLC配列から生じたアミロイド様の線維はSDSが0%の緩衝液に希釈するだけでほぼ完全に解離した.一方,アミロイド線維の代表例として用いた出芽酵母Sup35から構成された線維は5),2%のSDSにおいてもほとんど解離せず残った.よって,形態的にはよく似ていても,FUSあるいはhnRNPA2のもつLC配列から生じたアミロイド様の線維は,病原性の不可逆なアミロイド線維とは根本的に異なっていることがわかった.
5.FUSあるいはhnRNPA2のもつLC配列から生じたアミロイド様の線維はほかのタンパク質のもつLC配列と共重合する
LC配列から形成されるヒドロゲルはアミロイド様の線維の凝集体であることがわかったが,では,ほかのLC配列がヒドロゲルに蓄積するのはどのような機構によるのだろうか? FUSのもつLC配列(mCherryで標識)から生じたアミロイド様の線維を超音波により破砕し種となる細かい線維(シード)を作製して,この少量のシードを線維を形成していないFUSのもつLC配列(GFPで標識)の溶液に混ぜ,シードからの線維の成長を観察した.すると,mCherryで標識されたシードの両端から,GFPで標識された線維の成長するのが観察された.また,FUSのもつLC配列について異なった数のチロシン残基をセリン残基へと置換した変異体を用いた場合には,5個あるいは9個のチロシン残基を置換したLC配列変異体ではシードの成長が観察されたが,15個あるいは27個すべてのチロシン残基を置換したLC配列変異体ではシードの成長はまったく観察されなかった.これらは,さきのヒドロゲルとの結合実験およびstress granuleとの結合実験の結果と一致した.これらの結果より,FUSのもつLC配列から形成されたヒドロゲルに野生型および変異型のFUSのもつLC配列が蓄積するのは,FUSのもつLC配列がヒドロゲルを構成するアミロイド様の線維から延長して重合することによることがわかった.
さて,この場合は野生型にせよ変異体にせよ重合するのはシードと同じFUSのもつLC配列であり驚くべきことではない.ではRNA粒子に含まれるほかのタンパク質のもつLC配列の場合ではどうなのだろうか? 同じ実験をほかのいくつかのLC配列を用いて試みたところ,FUSのもつLC配列から生じたアミロイド様の線維から作製したシードから,hnRNPA1およびCIRBPのもつLC配列による線維の成長がみられた.また,hnRNAPA2のもつLC配列からなるシードからは,hnRNPA1およびRBM3のもつLC配列による線維の成長がみられた.すべての場合において,GFPにより標識されたLC配列による重合の部分に重なり,mCherryにより標識されたシードによる重合も観察された.おそらくこの部分では,シード溶液に残っていたmCherry標識LC配列とGFP標識LC配列とが共重合しながら線維を成長させているものと考えられた.このように,ヘテロなLC配列による場合でも,ヒドロゲルへの蓄積はシードからの線維の成長という分子機構により起こることが明らかになった.RNA粒子において異なるLC配列をもつタンパク質が集合するのも,このようなヘテロな共重合による線維の形成が起こっているからだと推察された.
6.ビオチン化イソオキサゾール化合物は水溶液中で微結晶化し表面にLC配列をもつタンパク質を結合させる
ビオチン化イソオキサゾール化合物がLC配列をもつタンパク質を特異的に沈殿させる分子機構を明らかにするため,まず,そのタンパク質の沈殿を顕微鏡により観察したところ,針状の微結晶からなる巨大な凝集体が観察された.この凝集体にエチジウムブロミドをくわえると,エチジウムブロミドに特有の波長で蛍光が観測された.細胞抽出液を含まない緩衝液にビオチン化イソオキサゾール化合物を混ぜたときにも同じような針状の微結晶が観察された.しかしこのとき,微結晶は小さなクラスターとして存在し,細胞抽出液において生じるような大きな凝集体ではなかった.また,この微結晶はエチジウムブロミドをくわえてもその蛍光は観測されなかった.以上のことより,ビオチン化イソオキサゾール化合物はそれ自体が水溶液中で微結晶化し,その微結晶がRNA粒子に含まれるLC配列をもつタンパク質(および,それらに結合した核酸)を特異的に吸着し,巨大な凝集体となり沈殿することがわかった(図1b).
では,ビオチン化イソオキサゾール化合物の微結晶はLC配列をもつタンパク質をどのように吸着するのであろうか? その謎を解くため,ビオチン化イソオキサゾール化合物のX線結晶構造を決定した.微結晶は細胞抽出液と同じ緩衝液を用いマクロシーディング法によりX線回折実験に適した大きさにまで成長させた.構造決定の結果,ビオチン化イソオキサゾール化合物の分子は伸びきった状態で非対称単位内の隣接する分子と結合し,結晶の内部ではそれぞれの分子が層状に入れ替わりに配列していた.その結果,結晶の表面では隣接した層が凸凹状になり長い溝を形成することが可能であることがわかった.この凸凹の距離はβストランド構造をとる1本のポリペプチドがちょうどはまり込むことのできる4.7Åであった.構造をもたないランダムコイル状のLC配列がこの溝にふれるとβストランド構造に変化し結合するものと考えられた.球状の構造をもつタンパク質には溝にはまってβストランド構造に変化するほど十分に長いフレキシブルな領域をもたないため,結晶の表面には結合できないのだろう.最後に,ビオチン化イソオキサゾール化合物によるタンパク質の沈殿が温度に依存して可逆的なのは,微結晶は37度に温めると溶解し結合していたLC配列がランダムコイル構造にもどるからだと考えられた.
おわりに
今回の研究より,筆者らは,これまで生物学的な機能が不明であったLC配列が,溶解状態からアミロイド様の線維へと可逆的に転換できることを見い出した.また,この可逆性のアミロイド様の線維は,膜をもたない凝集体であるRNA粒子の構造の基礎である可能性を示した.また,可逆性のアミロイド様の線維が異なるLC配列により共重合することで,多くのタンパク質がダイナミックに出入りするRNA粒子の形成されている可能性を示唆した.
この論文と同時に発表した付随論文では6),ビオチン化イソオキサゾール化合物による沈殿に含まれるRNAをRNAseq法により同定し,これまでRNA粒子に集合することが報告されていたすべてのmRNAが,ビオチン化イソオキサゾール化合物による沈殿に取り込まれることを確認し報告した.また,FUSのもつLC配列から形成されるヒドロゲルに結合するRNAを細胞抽出液から捕捉し同定したところ,ビオチン化イソオキサゾール化合物による沈殿に含まれるmRNAとほとんど同じmRNAがヒドロゲルに結合することを示した.ビオチン化イソオキサゾール化合物による沈殿とLC配列から形成されるヒドロゲルの両方とも,RNA粒子に含まれるタンパク質およびmRNAを正確に捕捉することができたことから,今後,これらの方法を用いたRNA粒子の生化学的な研究の促進されることが期待される.
文 献
- Anderson, P. & Kedersha, N.: RNA granules. J. Cell Biol., 172, 803-808 (2006)[PubMed]
- Michelitsch, M. D. & Weissman, J. S.: A census of glutamine/asparagine-rich regions: implications for their conserved function and the prediction of novel prions. Proc. Natl. Acad. Sci. USA, 97, 11910-11915 (2000)[PubMed]
- Sadek, H., Hannack, B., Choe, E. et al.: Cardiogenic small molecules that enhance myocardial repair by stem cells. Proc. Natl. Acad. Sci. USA, 105, 6063-6068 (2008)[PubMed]
- Smith, J. F., Knowles, T. P., Dobson, C. M. et al.: Characterization of the nanoscale properties of individual amyloid fibrils. Proc. Natl. Acad. Sci. USA, 103, 15806-15811 (2006)[PubMed]
- Wickner, R. B.: [URE3] as an altered URE2 protein: evidence for a prion analog in Saccharomyces cerevisiae. Science, 264, 566-569 (1994)[PubMed]
- Han, T. W., Kato, M., Xie, S. et al.: Cell-free formation of RNA granules: bound RNAs identify features and components of cellular assemblies. Cell, 149, 768-779 (2012)[PubMed]
著者プロフィール
略歴:1998年 奈良先端科学技術大学院大学バイオサイエンス研究科にて博士号取得,米国Harvard Medical School研究員を経て,米国Texas大学Southwestern Medical CenterにてAssistant Professor.
研究テーマ:可逆性のアミロイド様の線維の生物学的な機能と構造.
Steven L. McKnight
米国Texas大学Southwestern Medical CenterにてProfessor.
研究室URL:http://www4.utsouthwestern.edu/mcknightlab/
© 2012 加藤昌人・Steven L. McKnight Licensed under CC 表示 2.1 日本