回転子のないF1-ATPaseが一方向に“回転”することを高速原子間力顕微鏡により解明
飯野亮太1・内橋貴之2・安藤敏夫2・野地博行1
(1東京大学大学院工学系研究科 応用化学専攻,2金沢大学理工研究域 数物科学系)
email:飯野亮太
DOI: 10.7875/first.author.2011.130
High-speed atomic force microscopy reveals rotary catalysis of rotorless F1-ATPase.
Takayuki Uchihashi, Ryota Iino, Toshio Ando, Hiroyuki Noji
Science, 333, 755-758 (2011)
回転ナノモーターF1-ATPaseの固定子リングを高速原子間力顕微鏡により観察することで,固定子リングにおいてトルクを発生するβサブユニットは回転子であるγサブユニットがなくても,3つのサブユニットが一方向に順番を守ってATPを加水分解し構造変化することを明らかにした.これにより,F1-ATPaseの一方向への回転は固定子リングにより駆動されていることを示し,回転子と固定子リングとの相互作用が協同性の実現に必要不可欠であるとする従来の説をくつがえした.F1-ATPaseの固定子リングが回転子なしでも高い協同性を示すことは,F1-ATPaseと構造は似ているが回転子となるサブユニットをもたない生体ナノマシンであるRecAファミリータンパク質やAAA+ファミリータンパク質も同様の作動機構ではたらいていることを示唆する.
ATPは生命の活動をささえるエネルギー源となる重要な物質である.DNA複製の際に二本鎖DNAをほどくヘリカーゼ,新生タンパク質のフォールディングを助ける分子シャペロン,筋収縮や細胞内小胞輸送を担うリニアモータータンパク質,生体分子を膜透過させるトランスポーター,不要なタンパク質を除去するプロテアソームやプロテアーゼなど,生体ナノマシンのほとんどはATP加水分解のエネルギーを利用して機能を発揮する.
筆者らが研究対象としているATP合成酵素は,文字どおり細胞においてATPを合成する酵素である.ATP合成酵素は普遍的な酵素であり,細菌や動物,植物など,ほとんどの生物がもっている.しかしながら,ATP合成酵素の化学反応触媒の機構はとてもユニークで,ほかの酵素とは大きく異なり,構成サブユニットの力学的な回転のエネルギーを使いATPを合成する.F1-ATPaseはATP合成酵素の一部であり,単離したF1-ATPaseはATPを分解しながら回転する.F1-ATPaseが回転ナノモーターであることは,1997年,光学顕微鏡を用いた1分子リアルタイムイメージングにより証明され1),高いエネルギー変換効率(100%近い),大きな回転力(約40 pN nm,水中で自分より100倍以上も大きなものを回すことができる!),高い最高回転速度(負荷が小さければ1分間に10,000回転以上も回転する)など,すぐれた性質がこれまでに明らかにされている2,3).また,F1-ATPaseの立体構造をもとにこれが一方向に回転するしくみについても詳細な議論が行われてきている.この研究では,高速な原子間力顕微鏡(atomic force microscopy:AFM)を用いた1分子リアルタイムイメージング法により4-6),F1-ATPaseの回転のしくみの解明に取り組んだ.
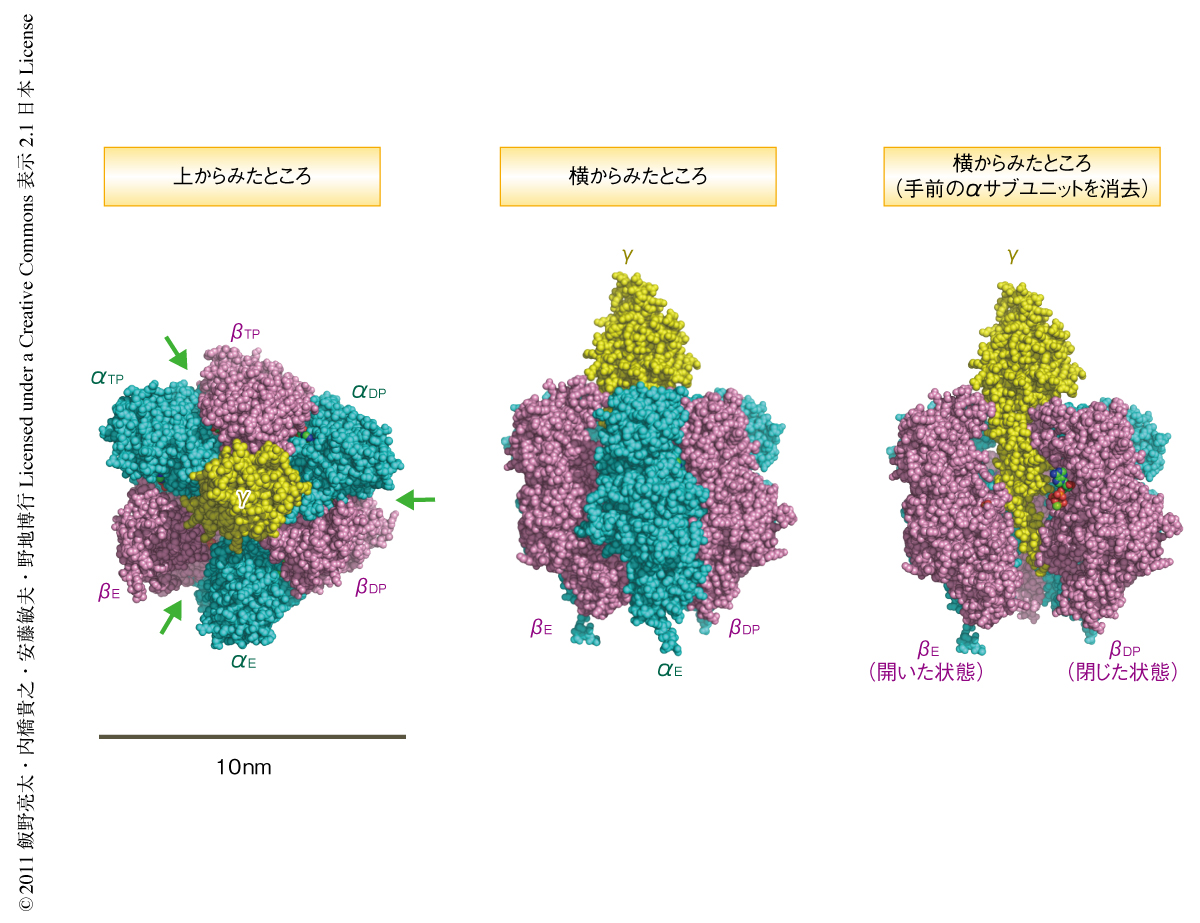
F1-ATPaseが回転ナノモーターとして機能する最小単位はα3β3γ複合体である.この複合体ではαサブユニットとβサブユニットとが3つずつ交互にならんで形成するα3β3固定子リングに回転子であるγサブユニットが突き刺さっている7)(図1).ATP加水分解反応の触媒部位はαサブユニット-βサブユニット界面に存在するが,ATPとの結合に寄与するアミノ酸残基のほとんどはβサブユニットに存在する.なお,反対側のβサブユニット-αサブユニット界面もATPと結合するが加水分解は行わない.結晶構造における3つのβサブユニットは結合しているヌクレオチドの状態が異なり,ATPまたはADPを結合した2つのβサブユニットは“閉じた構造”,ヌクレオチドを結合していない1つのβサブユニットは“開いた構造”をとっている.このため,βサブユニットはATPとの結合にともない開いた状態から閉じた状態へと大きくその構造が変化するものと考えられている.また,閉じた状態から開いた状態への変化は反応生成物であるADPやリン酸の解離にともない起こるものと考えられている8-10).そして,このβサブユニットの構造変化がγサブユニットの回転を駆動する.回転子であるγサブユニットが反時計回りに360度回転すると,それぞれのβサブユニットは1回のATP加水分解反応を完了しリセットされる.3つのβサブユニットの化学反応と構造変化のタイミングはたくみに制御されており,位相は互いに120度ずれている11).γサブユニットが一方向に回転するためにはこのタイミングの制御が重要だと考えられる.
F1-ATPaseの結晶構造をみると,閉じたβサブユニットはγサブユニットを押しているようにみえ,開いたβサブユニットはγサブユニットに押されているようにみえる.この“押し引き”が化学反応と構造変化のタイミングの制御に重要であるというのがこれまでもっとも有力な説であった12).すなわち,このモデルでは一方向への回転の実現にはγサブユニットとβサブユニットとの相互作用が必須となる.非対称なかたちをしたγサブユニットの回転角度が決まれば3つのβサブユニットの状態が自動的に規定され,いわば,γサブユニットが3つのβサブユニットの化学反応と構造変化のタイミングを支配する“独裁者γ”(dictatorγ)としての役割をはたすというモデルである.しかしながら最近,γサブユニットを短くしてβサブユニットとの接触点を大きく減らしてもF1-ATPaseは一方向に回転できるという報告がなされ,このモデルが必ずしも正しくはない可能性が示唆された13).
“回転子であるγサブユニットは本当にF1-ATPaseの化学力学共役を支配する独裁者なのか?” この問いは,γサブユニットのないα3β3固定子リングの3つのβサブユニットが,順番を守ってATPを加水分解し構造変化するかを調べれば直接に検証できる.しかしながら,光学顕微鏡を用いたF1-ATPaseの1分子リアルタイムイメージングでは,γサブユニットにプラスチックビーズなどの可視化プローブを結合させて回転を観察するためγサブユニットを取り除くことができない.別の方法として,個々のβサブユニットに蛍光色素を結合させその向きの変化からβサブユニットの構造変化を検出することも原理的には可能である.しかしながら,近接する3つのβサブユニットに結合させた3つの蛍光色素の向きの変化を同時にモニターするのは容易ではない.
そこで,光学顕微鏡の代わりに原子間力顕微鏡を利用することにした.原子間力顕微鏡は探針を観察対象の表面にそって走査することでその形状(凹凸)の情報(画像)を得る.縦(高さ)方向には原子サイズの分解能(0.1 nm)の達成が可能であり,横(走査)方向にも1 nm程度の高い分解能が達成できる.また,光学顕微鏡と異なり,プラスチックビーズや蛍光色素などの目印を結合させることなく1分子のタンパク質の構造変化を観察することができる.従来の原子間力顕微鏡はひとつの画像を取得するのに数分を要したためタンパク質の構造変化をリアルタイムでおうことは困難であったが,筆者らは,さまざまな改良を行うことで走査の高速化に成功し,リアルタイムで動画の撮れる高速な原子間力顕微鏡を世界ではじめて開発した4-6).この高速原子間力顕微鏡を用いて,回転子としてはたらくγサブユニットのないF1-ATPaseのα3β3固定子リングは一方向に“回転”できるのかどうかを検証した.
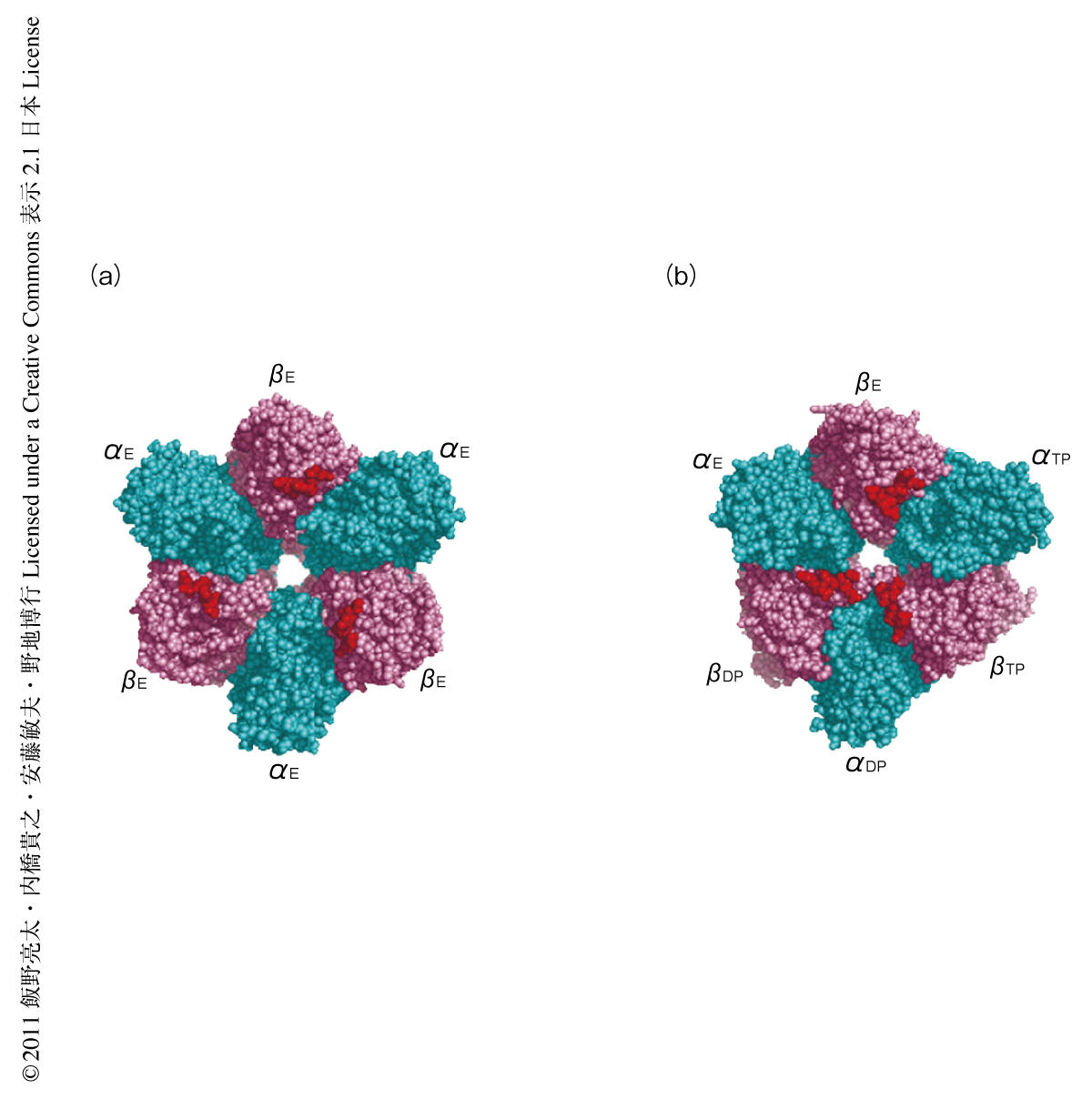
α3β3固定子リングのN末端側をマイカ基板の表面に共有結合により固定し,大きく構造変化するC末端側を80ミリ秒の時間分解能で観察した.ヌクレオチドなしの条件では疑似6回対称のリング構造が観察され,このリング構造を構成する6つのサブユニットのうち,βサブユニットに相当する3つは開いた構造をとっており,αサブユニットよりも高く突き出た構造をみせた(図2a).一方,加水分解しないATPアナログであるAMPPNPの存在下では,γサブユニットをもつα3β3γ複合体と同様に,2つのβサブユニットが閉じた(高さの)低い構造に変化し1つのβサブユニットのみが開いて高く突き出た非対称な構造をみせた(図2b).この結果は,γサブユニットがない場合にも,3つのβサブユニットは同時には閉じた状態になれないことを示していた.ヌクレオチドなしまたはAMPPNP存在下のどちらの条件でも,原子間力顕微鏡による像は結晶構造をもとにシミュレーションした疑似の原子間力顕微鏡の像と高い一致をみせ,C末端側がたしかに観察できていることが確認された.また,これらの条件ではα3β3固定子リングの構造は基本的に一定で,観察のあいだ変化しなかった.
さらに,ATPの存在下ではAMPPNPの存在下と同様に,1つのβサブユニットのみが開いた非対称な構造をみせただけでなく,βサブユニットの開閉のダイナミックな構造変化が観察された.特筆すべきは,開いたβサブユニットが閉じると反時計回り方向にある閉じたβサブユニットが同時に開くという,協同的な構造変化がみられた点である.このようにして,βサブユニットの開閉が時間の経過とともに反時計回りに遷移していくようすが明確に観察された.高さの解析だけでなく画像相関解析の結果からも3つのβサブユニットのうち1つのみが開いている状態が支配的であることが確認された.また,開いた状態の寿命の長さはATP濃度に反比例し,さらに,ATP加水分解速度の逆数(時定数)とよい一致をみせた.これにより,βサブユニットの構造変化はATP加水分解反応と共役して起こっていることが示された.
今回の結果から,F1-ATPaseの一方向への回転をささえる構造的な基盤はα3β3固定子リング自体に内蔵されており,回転子であるγサブユニットとの相互作用は必須でないことが明らかになった.よって,これまで主流だった“独裁者γ”モデルはあやまりであったといえる.α3β3固定子リングにある3つのβサブユニットは互いに直接には相互作用していないので,おそらくはαサブユニットとの相互作用を介して化学反応と構造変化のタイミングが制御されているのだと考えられる.実際に,ひとつのαサブユニット(もしくは,βサブユニット)が失われると固定子リング全体の構造変化が停止するようすも観察された.一方で,α3β3固定子リングの一方向への回転の効率(90%弱)や速度(2μM ATPの条件で0.2 Hz)は,γサブユニットのある場合(100%,約10Hz)に比べ低下していることも確かであった.よって,正確で速い回転触媒反応の実現には,α3β3固定子リングのサブユニットのあいだの相互作用だけでなく,回転子であるγサブユニットとα3β3固定子リングとの相互作用も同等に重要であると考えられる.どのサブユニットのあいだの相互作用も重要であることから,筆者らは,この新しいモデルを“民主的”(democratic)モデルとよんでいる.
この研究では,高速原子間力顕微鏡を用いてF1-ATPaseの回転のしくみの一端を明らかにすることができた.F1-ATPaseに似た六量体リング構造をもつけれども回転子となるサブユニットをもたないRecAファミリータンパク質やAAA+ファミリータンパク質は数多く存在する14).回転子がなくてもF1-ATPaseが“回転する”という今回の結果は,これらの生体ナノマシンもF1-ATPaseと同様にリング構造を形成するサブユニットどうしが高い協同性を発揮してはたらいていることを強く示唆する.これらのタンパク質の構造変化を高速原子間力顕微鏡により観察することで,F1-ATPaseとの共通点や相違点が明らかになると期待できる.
また,今回,明らかになったF1-ATPaseのしくみから応用研究への新たな可能性も開かれた.F1-ATPaseはα3β3固定子リング自体が回転することから,カーボンナノチューブなどγサブユニットと同じ程度のナノメートルサイズの人工物を代わりに突き刺せば一方向に回転するものと考えられ,ハイブリッドナノアクチュエーターの開発が期待される.さらに最近,光駆動で回転する人工ナノモーターが報告されているが15),F1-ATPaseと人工ナノモーターの回転子をつなぐことができれば,光に応答して回転しATPを合成するナノマシンを創りだせると期待できる.
略歴:2000年 名古屋大学大学院理学研究科 修了,同年ERATO楠見膜組織能プロジェクト 研究員,2002年ERATO吉田ATPシステムプロジェクト 研究員,2005年 大阪大学産業科学研究所 特任助手を経て,2011年より東京大学大学院工学系研究科 講師.
内橋 貴之(Takayuki Uchihashi)
略歴:1998年 大阪大学大学院工学研究科 修了,同年 アトムテクノロジー研究体 研究員,2000年 姫路工業大学工学部 助手,2002年アイルランドDublin大学Trinity College研究員,2004年 金沢大学理学部 助手を経て,2006年より同 理工研究域 准教授.
安藤 敏夫(Toshio Ando)
金沢大学理工研究域 教授.
野地 博行(Hiroyuki Noji)
東京大学大学院工学系研究科 教授.
© 2011 飯野亮太・内橋貴之・安藤敏夫・野地博行 Licensed under CC 表示 2.1 日本
(1東京大学大学院工学系研究科 応用化学専攻,2金沢大学理工研究域 数物科学系)
email:飯野亮太
DOI: 10.7875/first.author.2011.130
High-speed atomic force microscopy reveals rotary catalysis of rotorless F1-ATPase.
Takayuki Uchihashi, Ryota Iino, Toshio Ando, Hiroyuki Noji
Science, 333, 755-758 (2011)
要 約
回転ナノモーターF1-ATPaseの固定子リングを高速原子間力顕微鏡により観察することで,固定子リングにおいてトルクを発生するβサブユニットは回転子であるγサブユニットがなくても,3つのサブユニットが一方向に順番を守ってATPを加水分解し構造変化することを明らかにした.これにより,F1-ATPaseの一方向への回転は固定子リングにより駆動されていることを示し,回転子と固定子リングとの相互作用が協同性の実現に必要不可欠であるとする従来の説をくつがえした.F1-ATPaseの固定子リングが回転子なしでも高い協同性を示すことは,F1-ATPaseと構造は似ているが回転子となるサブユニットをもたない生体ナノマシンであるRecAファミリータンパク質やAAA+ファミリータンパク質も同様の作動機構ではたらいていることを示唆する.
はじめに
ATPは生命の活動をささえるエネルギー源となる重要な物質である.DNA複製の際に二本鎖DNAをほどくヘリカーゼ,新生タンパク質のフォールディングを助ける分子シャペロン,筋収縮や細胞内小胞輸送を担うリニアモータータンパク質,生体分子を膜透過させるトランスポーター,不要なタンパク質を除去するプロテアソームやプロテアーゼなど,生体ナノマシンのほとんどはATP加水分解のエネルギーを利用して機能を発揮する.
筆者らが研究対象としているATP合成酵素は,文字どおり細胞においてATPを合成する酵素である.ATP合成酵素は普遍的な酵素であり,細菌や動物,植物など,ほとんどの生物がもっている.しかしながら,ATP合成酵素の化学反応触媒の機構はとてもユニークで,ほかの酵素とは大きく異なり,構成サブユニットの力学的な回転のエネルギーを使いATPを合成する.F1-ATPaseはATP合成酵素の一部であり,単離したF1-ATPaseはATPを分解しながら回転する.F1-ATPaseが回転ナノモーターであることは,1997年,光学顕微鏡を用いた1分子リアルタイムイメージングにより証明され1),高いエネルギー変換効率(100%近い),大きな回転力(約40 pN nm,水中で自分より100倍以上も大きなものを回すことができる!),高い最高回転速度(負荷が小さければ1分間に10,000回転以上も回転する)など,すぐれた性質がこれまでに明らかにされている2,3).また,F1-ATPaseの立体構造をもとにこれが一方向に回転するしくみについても詳細な議論が行われてきている.この研究では,高速な原子間力顕微鏡(atomic force microscopy:AFM)を用いた1分子リアルタイムイメージング法により4-6),F1-ATPaseの回転のしくみの解明に取り組んだ.
1.F1-ATPaseが一方向に回転するしくみの従来までのモデル
F1-ATPaseが回転ナノモーターとして機能する最小単位はα3β3γ複合体である.この複合体ではαサブユニットとβサブユニットとが3つずつ交互にならんで形成するα3β3固定子リングに回転子であるγサブユニットが突き刺さっている7)(図1).ATP加水分解反応の触媒部位はαサブユニット-βサブユニット界面に存在するが,ATPとの結合に寄与するアミノ酸残基のほとんどはβサブユニットに存在する.なお,反対側のβサブユニット-αサブユニット界面もATPと結合するが加水分解は行わない.結晶構造における3つのβサブユニットは結合しているヌクレオチドの状態が異なり,ATPまたはADPを結合した2つのβサブユニットは“閉じた構造”,ヌクレオチドを結合していない1つのβサブユニットは“開いた構造”をとっている.このため,βサブユニットはATPとの結合にともない開いた状態から閉じた状態へと大きくその構造が変化するものと考えられている.また,閉じた状態から開いた状態への変化は反応生成物であるADPやリン酸の解離にともない起こるものと考えられている8-10).そして,このβサブユニットの構造変化がγサブユニットの回転を駆動する.回転子であるγサブユニットが反時計回りに360度回転すると,それぞれのβサブユニットは1回のATP加水分解反応を完了しリセットされる.3つのβサブユニットの化学反応と構造変化のタイミングはたくみに制御されており,位相は互いに120度ずれている11).γサブユニットが一方向に回転するためにはこのタイミングの制御が重要だと考えられる.
F1-ATPaseの結晶構造をみると,閉じたβサブユニットはγサブユニットを押しているようにみえ,開いたβサブユニットはγサブユニットに押されているようにみえる.この“押し引き”が化学反応と構造変化のタイミングの制御に重要であるというのがこれまでもっとも有力な説であった12).すなわち,このモデルでは一方向への回転の実現にはγサブユニットとβサブユニットとの相互作用が必須となる.非対称なかたちをしたγサブユニットの回転角度が決まれば3つのβサブユニットの状態が自動的に規定され,いわば,γサブユニットが3つのβサブユニットの化学反応と構造変化のタイミングを支配する“独裁者γ”(dictatorγ)としての役割をはたすというモデルである.しかしながら最近,γサブユニットを短くしてβサブユニットとの接触点を大きく減らしてもF1-ATPaseは一方向に回転できるという報告がなされ,このモデルが必ずしも正しくはない可能性が示唆された13).
2.高速原子間力顕微鏡:目印を必要としない高分解能な1分子リアルタイムイメージング法
“回転子であるγサブユニットは本当にF1-ATPaseの化学力学共役を支配する独裁者なのか?” この問いは,γサブユニットのないα3β3固定子リングの3つのβサブユニットが,順番を守ってATPを加水分解し構造変化するかを調べれば直接に検証できる.しかしながら,光学顕微鏡を用いたF1-ATPaseの1分子リアルタイムイメージングでは,γサブユニットにプラスチックビーズなどの可視化プローブを結合させて回転を観察するためγサブユニットを取り除くことができない.別の方法として,個々のβサブユニットに蛍光色素を結合させその向きの変化からβサブユニットの構造変化を検出することも原理的には可能である.しかしながら,近接する3つのβサブユニットに結合させた3つの蛍光色素の向きの変化を同時にモニターするのは容易ではない.
そこで,光学顕微鏡の代わりに原子間力顕微鏡を利用することにした.原子間力顕微鏡は探針を観察対象の表面にそって走査することでその形状(凹凸)の情報(画像)を得る.縦(高さ)方向には原子サイズの分解能(0.1 nm)の達成が可能であり,横(走査)方向にも1 nm程度の高い分解能が達成できる.また,光学顕微鏡と異なり,プラスチックビーズや蛍光色素などの目印を結合させることなく1分子のタンパク質の構造変化を観察することができる.従来の原子間力顕微鏡はひとつの画像を取得するのに数分を要したためタンパク質の構造変化をリアルタイムでおうことは困難であったが,筆者らは,さまざまな改良を行うことで走査の高速化に成功し,リアルタイムで動画の撮れる高速な原子間力顕微鏡を世界ではじめて開発した4-6).この高速原子間力顕微鏡を用いて,回転子としてはたらくγサブユニットのないF1-ATPaseのα3β3固定子リングは一方向に“回転”できるのかどうかを検証した.
3.F1-ATPaseの固定子リングは回転子がなくても一方向に“回転”する
α3β3固定子リングのN末端側をマイカ基板の表面に共有結合により固定し,大きく構造変化するC末端側を80ミリ秒の時間分解能で観察した.ヌクレオチドなしの条件では疑似6回対称のリング構造が観察され,このリング構造を構成する6つのサブユニットのうち,βサブユニットに相当する3つは開いた構造をとっており,αサブユニットよりも高く突き出た構造をみせた(図2a).一方,加水分解しないATPアナログであるAMPPNPの存在下では,γサブユニットをもつα3β3γ複合体と同様に,2つのβサブユニットが閉じた(高さの)低い構造に変化し1つのβサブユニットのみが開いて高く突き出た非対称な構造をみせた(図2b).この結果は,γサブユニットがない場合にも,3つのβサブユニットは同時には閉じた状態になれないことを示していた.ヌクレオチドなしまたはAMPPNP存在下のどちらの条件でも,原子間力顕微鏡による像は結晶構造をもとにシミュレーションした疑似の原子間力顕微鏡の像と高い一致をみせ,C末端側がたしかに観察できていることが確認された.また,これらの条件ではα3β3固定子リングの構造は基本的に一定で,観察のあいだ変化しなかった.
さらに,ATPの存在下ではAMPPNPの存在下と同様に,1つのβサブユニットのみが開いた非対称な構造をみせただけでなく,βサブユニットの開閉のダイナミックな構造変化が観察された.特筆すべきは,開いたβサブユニットが閉じると反時計回り方向にある閉じたβサブユニットが同時に開くという,協同的な構造変化がみられた点である.このようにして,βサブユニットの開閉が時間の経過とともに反時計回りに遷移していくようすが明確に観察された.高さの解析だけでなく画像相関解析の結果からも3つのβサブユニットのうち1つのみが開いている状態が支配的であることが確認された.また,開いた状態の寿命の長さはATP濃度に反比例し,さらに,ATP加水分解速度の逆数(時定数)とよい一致をみせた.これにより,βサブユニットの構造変化はATP加水分解反応と共役して起こっていることが示された.
4.F1-ATPaseが一方向に回転するしくみの新しいモデル
今回の結果から,F1-ATPaseの一方向への回転をささえる構造的な基盤はα3β3固定子リング自体に内蔵されており,回転子であるγサブユニットとの相互作用は必須でないことが明らかになった.よって,これまで主流だった“独裁者γ”モデルはあやまりであったといえる.α3β3固定子リングにある3つのβサブユニットは互いに直接には相互作用していないので,おそらくはαサブユニットとの相互作用を介して化学反応と構造変化のタイミングが制御されているのだと考えられる.実際に,ひとつのαサブユニット(もしくは,βサブユニット)が失われると固定子リング全体の構造変化が停止するようすも観察された.一方で,α3β3固定子リングの一方向への回転の効率(90%弱)や速度(2μM ATPの条件で0.2 Hz)は,γサブユニットのある場合(100%,約10Hz)に比べ低下していることも確かであった.よって,正確で速い回転触媒反応の実現には,α3β3固定子リングのサブユニットのあいだの相互作用だけでなく,回転子であるγサブユニットとα3β3固定子リングとの相互作用も同等に重要であると考えられる.どのサブユニットのあいだの相互作用も重要であることから,筆者らは,この新しいモデルを“民主的”(democratic)モデルとよんでいる.
おわりに
この研究では,高速原子間力顕微鏡を用いてF1-ATPaseの回転のしくみの一端を明らかにすることができた.F1-ATPaseに似た六量体リング構造をもつけれども回転子となるサブユニットをもたないRecAファミリータンパク質やAAA+ファミリータンパク質は数多く存在する14).回転子がなくてもF1-ATPaseが“回転する”という今回の結果は,これらの生体ナノマシンもF1-ATPaseと同様にリング構造を形成するサブユニットどうしが高い協同性を発揮してはたらいていることを強く示唆する.これらのタンパク質の構造変化を高速原子間力顕微鏡により観察することで,F1-ATPaseとの共通点や相違点が明らかになると期待できる.
また,今回,明らかになったF1-ATPaseのしくみから応用研究への新たな可能性も開かれた.F1-ATPaseはα3β3固定子リング自体が回転することから,カーボンナノチューブなどγサブユニットと同じ程度のナノメートルサイズの人工物を代わりに突き刺せば一方向に回転するものと考えられ,ハイブリッドナノアクチュエーターの開発が期待される.さらに最近,光駆動で回転する人工ナノモーターが報告されているが15),F1-ATPaseと人工ナノモーターの回転子をつなぐことができれば,光に応答して回転しATPを合成するナノマシンを創りだせると期待できる.
文 献
- Noji, H., Yasuda, R., Yoshida, M. et al.: Direct observation of the rotation of F1-ATPase. Nature, 386, 299-302 (1997)[PubMed]
- Yasuda, R., Noji, H., Kinosita, K., Jr. et al. .: F1-ATPase is a highly efficient molecular motor that rotates with discrete 120 degree steps. Cell, 93, 1117-1124 (1998)[PubMed]
- Yasuda, R., Noji, H., Yoshida, M. et al..: Resolution of distinct rotational substeps by submillisecond kinetic analysis of F1-ATPase. Nature, 410, 898-904 (2001)[PubMed]
- Ando, T., Kodera, N., Takai, E. et al.: A high-speed atomic force microscope for studying biological macromolecules. Proc. Natl. Acad. Sci. USA, 98, 12468-12472 (2001)[PubMed]
- Shibata, M., Yamashita, H., Uchihashi, T. et al.: High-speed atomic force microscopy shows dynamic molecular processes in photoactivated bacteriorhodopsin. Nat. Nanotechnol., 5, 208-212 (2010)[PubMed]
- Kodera, N., Yamamoto, D., Ishikawa, R. et al.: Video imaging of walking myosin V by high-speed atomic force microscopy. Nature, 468, 72-76 (2010)[PubMed] [新着論文レビュー]
- Abrahams, J. P., Leslie, A. G., Lutter, R. et al.: Structure at 2.8Å resolution of F1-ATPase from bovine heart mitochondria. Nature, 370, 621-628 (1994)[PubMed]
- Masaike, T., Koyama-Horibe, F., Oiwa, K. et al.: Cooperative three-step motions in catalytic subunits of F1-ATPase correlate with 80 degrees and 40 degrees substep rotations. Nat. Struct. Mol .Biol., 15, 1326-1333 (2008)[PubMed]
- Adachi, K., Oiwa, K., Nishizaka, T. et al.: Coupling of rotation and catalysis in F1-ATPase revealed by single-molecule imaging and manipulation. Cell, 130, 309-321 (2007)[PubMed]
- Watanabe, R., Iino, R. & Noji, H.: Phosphate release in F1-ATPase catalytic cycle follows ADP release. Nat. Chem. Biol., 6, 814-820 (2010)[PubMed] [新着論文レビュー]
- Ariga, T., Muneyuki, E. & Yoshida, M.: F1-ATPase rotates by an asymmetric, sequential mechanism using all three catalytic subunits. Nat. Struct. Mol. Biol., 14, 841-846 (2007)[PubMed]
- Wang, H. & Oster, G.: Energy transduction in the F1 motor of ATP synthase. Nature, 396, 279-282 (1998)[PubMed]
- Furuike, S., Hossain, M. D., Maki, Y. et al.: Axle-less F1-ATPase rotates in the correct direction. Science, 319, 955-958 (2008)[PubMed]
- Enemark, E. J. & Joshua-Tor, L.: On helicases and other motor proteins. Curr. Opin. Struct. Biol., 18, 243-257 (2008)[PubMed]
- Browne, W. R. & Feringa, B. L.: Making molecular machines work. Nat. Nanotechnol., 1, 25-35 (2006)[PubMed]
著者プロフィール
略歴:2000年 名古屋大学大学院理学研究科 修了,同年ERATO楠見膜組織能プロジェクト 研究員,2002年ERATO吉田ATPシステムプロジェクト 研究員,2005年 大阪大学産業科学研究所 特任助手を経て,2011年より東京大学大学院工学系研究科 講師.
内橋 貴之(Takayuki Uchihashi)
略歴:1998年 大阪大学大学院工学研究科 修了,同年 アトムテクノロジー研究体 研究員,2000年 姫路工業大学工学部 助手,2002年アイルランドDublin大学Trinity College研究員,2004年 金沢大学理学部 助手を経て,2006年より同 理工研究域 准教授.
安藤 敏夫(Toshio Ando)
金沢大学理工研究域 教授.
野地 博行(Hiroyuki Noji)
東京大学大学院工学系研究科 教授.
© 2011 飯野亮太・内橋貴之・安藤敏夫・野地博行 Licensed under CC 表示 2.1 日本