Variações dos valores séricos do CEA, bilirrubinas e aminotransferases em indivíduos oncológicos
Variations of serum values of CEA, bilirubins and aminotransferases in oncologic individuals
Ana Catarina Simonetti1
José Humberto de Lima Melo2
Érica Carla Barbosa Andrade3
Vinicius Soares de Vasconcelos4
- Farmacêutica-Bioquímica e Doutora em Ciências Biológicas/Universidade Federal de Pernambuco. Centro Universitário Tabosa de Almeida/Asces-Unita. Caruaru-PE, Brasil.
- Biomédico. Rede D’Or São Luiz – Hospital São Marcos – Recife-PE, Brasil.
- Biomédica. Laboratório de Análises Clínicas Gilson Cidrim – Recife-PE, Brasil.
- Farmacêutico. Centro Universitário Tabosa de Almeida/Asces-Unita – Caruaru-PE, Brasil.
Instituições: Centro Universitário Tabosa de Almeida/Asces-Unita-Caruaru-PE, Rede D’Or São Luiz-Hospital São Marcos e Laboratório de Análises Clínicas Gilsom Cidrim – Recife-PE, Brasil.
Artigo recebido em 29/09/2017
Artigo aprovado em 12/04/2018
DOI: 10.21877/2448-3877.201800623
Resumo
Objetivo: esta pesquisa baseou-se na determinação sérica de marcadores biológicos importantes, em indivíduos oncológicos, para uma possível detecção prognóstica de câncer colorretal, tais como o CEA (antígeno carcinoembrionário), as aminotransferases (ALT e AST) e a bilirrubina total (BT) e suas frações direta (BD) e indireta (BI). Métodos: prontuários arquivados de indivíduos (n=80), atendidos no ambulatório e sob internação do setor de oncologia do Hospital Barão de Lucena, localizado em Recife, Pernambuco, Brasil, foram catalogados para análise. O estudo de coorte transversal foi adotado para se avaliar a prevalência de positividade do CEA, correlacionada com os índices séricos elevados das bilirrubinas e aminotransferases. Resultados: o percentual mais elevado de indivíduos com valores alterados, em cada marcador biológico analisado, correspondeu ao sexo masculino, com a maior diferença observada para BI (44,0% vs. 18,2%). O percentual de resultados com alteração para AST, BT, BD e BI foi correspondentemente maior entre os indivíduos que expressaram valores de CEA alterados, com as duas maiores diferenças constatadas para BT (20,6% vs. 8,7%) e BI (35,3% vs. 19,6%). Conclusão: a associação dos biomarcardores séricos (CEA, bilirrubinas e aminotransferases) não demonstrou resultados significativos. Entretanto, valores do CEA alterados não podem ser desconsiderados, pois, quando averiguados isoladamente, inferem um possível risco de desenvolvimento de neoplasias do sistema digestório, principalmente na região colorretal, assim como da mama, do pulmão e do ovário.
Palavras-chave
Marcadores biológicos; Antígeno carcinoembrionário; Bilirrubina; Alanina transaminase; Aspartato aminotransferases
INTRODUÇÃO
O câncer é uma doença relativamente comum, responsável por 25% de todas as causas de óbito no mundo, apresentando taxas de morbimortalidade mais expressivas em países desenvolvidos devido à expectativa de vida mais elevada e, consequentemente, à prevalência de doenças de caráter crônico degenerativo.(1,2) O Brasil deverá seguir esta tendência, mais tardiamente, conforme às mudanças estruturais que alterem o quadro das desigualdades sociais que poderão influenciar na redução dos fatores responsáveis pelas mortes decorrentes de causas externas. Conforme projeções do Instituto Nacional do Câncer (Inca),(3) estima-se, para o biênio 2016-2017, 600 mil novos casos desta doença na população brasileira.
A mortalidade por câncer é dependente das taxas de incidência, de prevalência e da experiência de sobrevida após o diagnóstico. Os estudos de mortalidade são úteis não apenas para a avaliação do problema de câncer em uma comunidade, mas também para a estimativa da efetividade das estratégias de prevenções primária e secundária de controle da doença, assim como para o impacto do tratamento na sobrevida dos indivíduos acometidos.(4) Embora os fatores genéticos exerçam papel fundamental na carcinogênese, a ocorrência dessa enfermidade é fortemente influenciada pela predominância de fatores externos que, em conjunto, são responsáveis por cerca de 80% a 90% dos casos de incidência. Dessa forma, características populacionais específicas de exposição relacionadas à dieta e nutrição, prevalência de tabagismo, viroses, exposições ambientais e ocupacionais, fatores atrelados às desigualdades sociais são, provavelmente, os principais determinantes de mortalidade.(5)
O câncer colorretal (CCR) representa a terceira causa de morte no mundo por neoplasia, tanto para homens, quanto para mulheres.(6) Os índices de mortalidade vêm se alterando lentamente, não obstante os recentes avanços obtidos no diagnóstico precoce e tratamento. No Brasil, a evolução do CCR tem apresentado comportamento semelhante, sendo, no momento, a quinta causa mais comum de morte relacionada aos cânceres nas regiões Sul e Sudeste.(7)
Marcadores Tumorais
Marcadores tumorais são definidos como moléculas biológicas encontradas na circulação sanguínea, fluidos corporais ou em tecidos, como reflexo de processos fisiológicos ou patológicos. Tais marcadores não são necessariamente produtos únicos das células malignas, mas podem estar sendo expressos pelo tumor em quantidades superiores em relação às células normais. A sua detecção é efetivada por métodos laboratoriais e, assim, pode ser correlacionada com a presença e/ou com o progresso de uma neoplasia.(8)
A possível utilização desses marcadores como método de detecção do câncer, em indivíduos assintomáticos, tem despertado um grande interesse por parte dos pesquisadores. Em decorrência do custo elevado e da baixa especificidade desses exames, ou seja, por não indicarem precisamente o órgão afetado, na maioria das vezes, o seu uso como um método de investigação de rotina é desaconselhável. Entretanto, os marcadores tumorais são bastante valiosos para o diagnóstico, estudos prognósticos e tratamento do câncer. Nesses dois últimos casos, quando um marcador não mais é constatado na amostra sanguínea é provável que o tratamento tenha sido bem sucedido, porém o seu reaparecimento é indicativo de uma recidiva dessa doença.(9)
O CEA é um antígeno glicoproteico encontrado no epitélio gastrintestinal, que migra eletroforeticamente na área b-globulina, geralmente associado aos carcinomas do sistema digestório, mama e pulmão, os quais comumente metastatizam para a pleura. Este antígeno tumoral é constituído por um conjunto de outras glicoproteínas semelhantes, pertencentes à família das imunoglobulinas, com peso molecular de 200 kDa, cuja principal função é promover a adesão intercelular.(10) Trata-se de uma proteína expressa por tumores originários do tecido endodérmico, em especial os da mucosa do cólon, que possui determinantes antigênicos localizados na fração proteica da molécula formada por cadeias polipeptídicas simples, sendo o componente carboidrato composto principalmente por frutose, manose, galactose, N-acetilglucosamina e N-acetil-galactosamina.(11)
A dosagem do CEA e de outros analitos bioquímicos tem sido realizada em efusões pleurais na tentativa de identificar marcadores tumorais que poderiam discriminar a etiologia benigna e maligna dos tumores.(12) Muitos autores sugerem a avaliação de alguns produtos tumorais, utilizando-se tanto o soro quanto o líquido pleural de indivíduos com suspeita de derrame pleural maligno. Estudos histoquímicos destacam a importância de diversos marcadores tumorais, tais como: CEA; antígenos carboidrato 125 (CA125), 19-9 (CA19-9), 15-3 (CA15-3), 72-4 (CA72-4) e 50 (CA50); gonadotrofina coriônica humana (hCG); alfafetoproteína (AFP), dentre outros.(13) Na suspeita de neoplasia, esses marcadores podem sugerir a etiologia maligna do derrame pleural. A avaliação da concentração do CEA é a que tem sido mais adotada, provavelmente por se tratar de um método acessível e de fácil interpretação clínico-laboratorial. No entanto, os resultados encontrados são bastante variáveis, sendo questionados por alguns autores.(14,15)
A detecção sérica do CEA, antígeno não específico, associa-se às outras malignidades, como as de estômago, pâncreas, gastrintestinais, mama, pulmão e ovário. Em geral, esse marcador está presente também em doenças benignas, tais como hepatopatias, pancreatites, enfisema pulmonar, tumores benignos da mama, colite ulcerativa, doença de Crohn e pólipo retal. Esse método não invasivo é utilizado na monitoração de tumores gastrintestinais, particularmente no câncer colorretal. Níveis pré-operatórios elevados são prognósticos de elevadas taxas de recidiva e de baixas taxas de sobrevida, podendo ser encontrados em metástases ósseas e hepáticas.(10)
Existem autores que afirmam que dosagens de fosfatase alcalina (FA) e gama-glutamiltransferase (GGT) contribuem para seu estadiamento e/ou acompanhamento dos enfermos submetidos à operação colorretal, por enfermidades malignas; e várias técnicas têm sido adotadas, rotineiramente, para a detecção de metástases hepáticas e acompanhamento pós-operatório. No entanto, alguns estudos afirmam que as dosagens dessas enzimas não contribuem para o diagnóstico das recidivas dos tumores colorretais.(16)
A bilirrubina é um pigmento resultante do catabolismo da hemoglobina, após a degradação (fisiológica ou patológica) dos eritrócitos. Ao passar pelo interior dos hepatócitos, a bilirrubina conjuga-se ao ácido glicurônico, transformando-se em mono e diglicuronídio de bilirrubina, o que ocorre sob a ação de uma enzima específica, a glicuroniltransferase. Desta forma, a bilirrubina encontra-se no plasma sob duas formas distintas: I) glicuronídios de bilirrubina e II) bilirrubina livre, não es fortemente ligada às proteínas plasmáticas, especialmente à albumina. Somente a forma conjugada de bilirrubina (fração direta, solúvel em água) é eliminada pelo fígado e rim, não sendo a forma indireta. Níveis elevados de bilirrubina, em um intervalo de variação referencial, estão associados a menores riscos de incidência e mortalidade por neoplasias, especialmente no que se refere ao câncer colorretal.(17-19)
As aminotransferases são enzimas envolvidas, sobretudo, no processo de metabolização de aminoácidos. As principais enzimas desta classe são: I) Aspartato Aminotransferase (AST), encontrada principalmente no citoplasma dos hepatócitos e II) Alanina Aminotransferase (ALT), cuja fração majoritária (80%) concentra-se na mitocôndria dos hepatócitos. O extravasamento das aminotransferases para o meio extracelular com o subsequente aumento da atividade sérica destas enzimas ocorre mediante estigmas físicos ao fígado. Em casos de dano hepatocelular leve, observa-se a predominância da forma citoplasmástica (AST), enquanto que, em casos de dano severo, elevação conjunta das formas citoplasmática (AST) e mitocondrial (ALT) é factível.(20) Diversos estudos têm elencado uma relação direta entre o aumento da concentração sérica das aminotransferases e o risco de desenvolvimento e progressão de neoplasias.(21-23)
O objetivo dessa pesquisa baseou-se na identificação de marcadores biológicos importantes, em indivíduos oncológicos, para uma possível detecção prognóstica de câncer colorretal, tais como o CEA, as aminotransferases (ALT e AST) e a bilirrubina total (BT) e suas frações direta (BD) e indireta (BI).
MATERIAL E MÉTODOS
Casuística
Prontuários arquivados de pacientes (n=80) atendidos no ambulatório e sob internação do setor de Oncologia do Hospital Barão de Lucena (HBL), localizado em Recife-PE, Brasil, foram catalogados para análise. O estudo de coorte transversal foi adotado para se avaliar a prevalência de positividade do CEA, correlacionada com os índices séricos elevados das bilirrubinas e aminotransferases.
Foram incluídos na pesquisa dados de pacientes ambulatoriais ou sob internação, de ambos os sexos, com idade superior a 14 e inferior a 80 anos. Os critérios de exclusão englobaram gestantes, recém-nascidos, crianças menores de 13 anos, indivíduos acima dos 80 anos e/ou com histórico médico de carcinoma comprovado e que foram submetidos a qualquer tipo de tratamento antineoplásico (Ex.: quimioterapia e radioterapia); assim como pacientes com processos benignos, a exemplo de outras doenças hepáticas (Ex.: cirrose, pancreatite e úlcera). Prontuários com preenchimento ilegível e com possibilidade de extravio também foram desconsiderados.
Ensaios Imunológico e Bioquímico
A análise do CEA foi feita pelo aparelho Elecsys 2010 da Abbot Diagnóstica S/A, baseado no conceito da eletroquimioluminescência, com tempo total de reação de 9 a 18 minutos. As dosagens das aminotransferases e bilirrubinas foram determinadas pelo analisador de sistema randômico e turbidimétrico Hitachi 912 da Roche, com identificação das amostras por código de barras. A operação de ambos os aparelhos, de simples execução, permitiu a aquisição de informações sobre a calibração e programação dos parâmetros, por sua vez transferidas ao sistema, através de código de barras bidimensional. Esse procedimento dispensou a entrada de dados via teclado para a realização das análises imunológica e bioquímica, a partir de 10 uL de soro do indivíduo. O controle de qualidade foi realizado automaticamente, em intervalos definidos.
Processamento e Análise dos Dados
Para a análise dos dados, foram obtidas distribuições absolutas, percentuais, medidas estatísticas (média, mediana e desvio padrão) e os valores de mínimo e máximo das variáveis sexo e idade, por meio do teste estatístico Qui-quadrado de Pearson, ou o teste Exato de Fisher, quando as condições para utilização do primeiro teste não foram possíveis.
A tabulação dos dados foi realizada na planilha Excel 2003 (Microsoft Corporation), enquanto que a análise dos dados foi efetuada no programa Statistical Package for the Social Sciences (SPSS), na versão 13. A margem de erro de 5,0% (p<0,05) foi adotada para efetivação dos testes estatísticos. Como base na análise dos prontuários obtidos, os seguintes valores de referência foram adotados: CEA, até 3,4 ng/mL; AST, até 38 U/L; ALT, até 41 U/L; BT, até 1,10 mg/dL; BD, até 0,40 mg/dL e BI, até 0,70 mg/dL.
Ética
A realização dessa pesquisa foi aprovada pelo Comitê de Ética em Pesquisa (CEP) do Centro Universitário Tabosa de Almeida/Asces-Unita, sob o protocolo de n° 046/08.
RESULTADOS
De um total de 80 indivíduos, 68,8% (n=55) pertenciam ao sexo feminino, enquanto que 31,3% (n=25), ao sexo masculino, conforme Gráfico 1. A idade do grupo de estudo variou em mínima e máxima de, respectivamente, 35 e 83 anos, com média de 55,60 ± 12,63 anos e mediana de 56,50 anos.
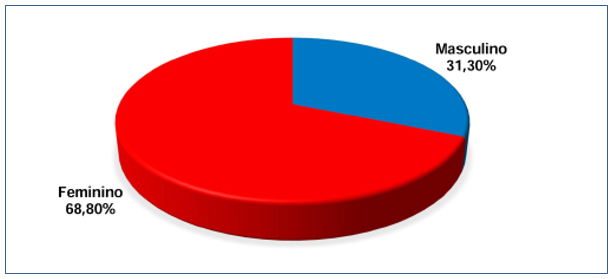
Figura 1. Distribuição dos pesquisados segundo o sexo.
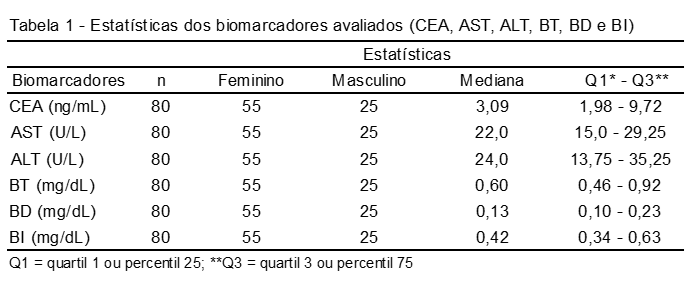
O marcador biológico CEA apresentou mediana de 3,09 ng/mL, enquanto que as aminotranferases (AST e ALT) e bilirrubinas (BT, BD e BI) demonstraram valores de mediana, respectivamente, de: 22 U/L; 24 U/L; 0,60 mg/dL; 0,13 mg/dL e 0,42 mg/dL. A Tabela 1 apresenta as estatísticas dos biomarcadores CEA, AST, ALT, BT, BD e BI.
Em relação ao sexo dos pesquisados no estudo foi observado que o percentual mais elevado de indivíduos com valores alterados, em cada marcador biológico analisado, correspondia ao sexo masculino. A maior diferença percentual foi registrada para a BI (44% vs. 18,2%), sendo este o único biomarcador que apresentou associação com o sexo em nível de significância considerado (p<0,05).
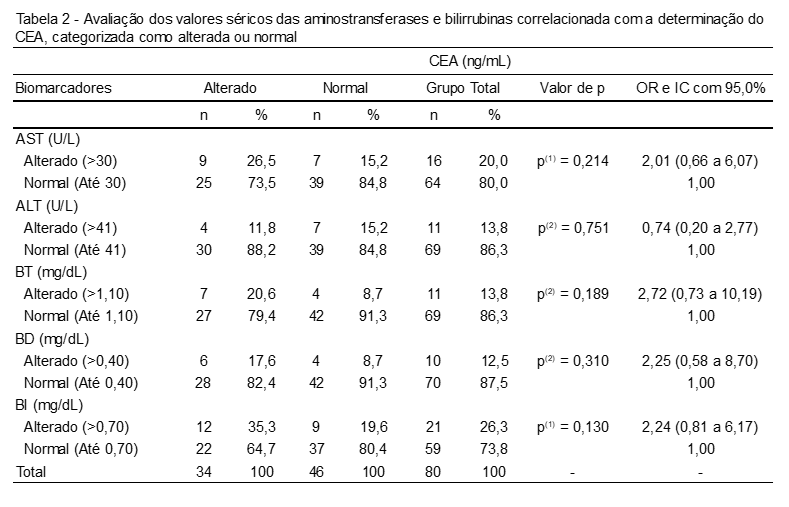
Na análise dos resultados das aminotransferases e bilirrubinas, segundo os resultados do CEA, verificou-se que, com exceção de ALT, o percentual de dados com alteração foi correspondentemente mais elevado entre os pacientes que expressaram valores divergentes de CEA, mediante padrão referenciais, sendo as duas maiores diferenças constatadas para BI (35,3% vs. 19,6%) e BT (17,6% vs. 8,7%). A associação entre os níveis séricos do CEA e os demais biomarcadores averiguados (AST, ALT, BT, BD e BI) não foi significativamente comprovada (p>0,05). A Tabela 2 demonstra os valores das aminotransferases e bilirrubinas em relação ao CEA.
DISCUSSÃO
A dosagem do CEA e de outros analitos bioquímicos tem sido realizada na tentativa de identificar marcadores tumorais capazes de discriminar a etiologia benigna ou maligna dessas neoplasias.(16) A busca por novos biomarcadores séricos ou teciduais é um fator indispensável para o diagnóstico precoce dos cânceres. Esses marcadores deveriam ser, em tese, detectados antes mesmo do desenvolvimento macroscópico do tumor, permitindo a intervenção clínica prévia do processo da invasão, angiogênese e disseminação metastática. Com isso, alterar-se-ia de forma muito significativa o prognóstico dessa enfermidade, com maiores índices de tratamento de indivíduos e possibilidades de cura.(24) A determinação dos biomarcadores delimita uma condição na qual se pode ter a capacidade de prever o surgimento de metástases em indivíduos operados curativamente, ou seja, a quantificação sorológica de alguns marcadores prediz, com certa clareza, se o indivíduo corre risco de vir a desenvolver uma recidiva tumoral. Essa condição pode influenciar no uso da quimioterapia adjuvante e intensificar o seguimento dos pacientes, com indicação de tratamento cirúrgico para lesões extirpáveis.(25,26)
Tendo em vista que o CEA é uma glicoproteína produzida pela célula neoplásica, acredita-se que a sua detecção é específica para o adenocarcinoma do cólon, porém, resultados alterados também puderam ser constatados em casos de carcinoma do cólon, de neoplasias malignas em vários órgãos, de tumores benignos e em indivíduos fumantes.(27) Os níveis séricos do CEA em doenças malignas divergem não apenas com o tipo de tumor, mas também com o seu estágio de progressão, sendo geralmente mais elevados em indivíduos com doença metastática. Embora o CEA não seja útil para triagem ou diagnóstico, ele tem sido indicado no acompanhamento clínico de pacientes com diversos tipos de câncer, especialmente àqueles portadores de carcinoma colorretal, nos quais os níveis pré-operatórios frequentemente estão elevados e se correlacionam com a histologia tumoral e condição patológica. Indivíduos com níveis pré-operatórios elevados, ou seja, acima de 10 ng/mL, apresentam prognóstico mais desfavorável em relação àqueles com índices inferiores ao referencial supracitado.(28,29)
Analisando individualmente os valores do CEA, os resultados apontaram dosagens medianas baixas em comparação com os valores de referência, do padrão para não fumantes (3,09 ng/mL vs. 3,4 ng/mL, respectivamente). As principais indicações para a dosagem desse biomarcador mostram-se nos casos de investigação prognóstica pré-operatória em câncer colorretal e nos seguimentos de indivíduos com câncer colorretal tratado.(30) Isoladamente, esses dados demonstraram que esses indivíduos são alvos potenciais para o desenvolvimento de processos neoplásicos, destacando-se os cânceres de cólon, reto, fígado e pulmão, o que demonstra o valor desse antígeno tumoral no acompanhamento dos estados clínico e terapêutico. Contudo, deve-se lembrar que a sua dosagem também pode-se encontrar alterada em processos benignos, doenças hepáticas, pancreatite, úlcera gástrica e até no tabagismo.(6)
A detecção do CEA não tem valor prognóstico quando realizada como triagem, porém é possível haver correlação entre os seus níveis séricos elevados com os estágios da doença neoplásica. Entretanto, a literatura afirma que duas taxas séricas elevadas, em um intervalo de 3 a 4 semanas, em pacientes assintomáticos com doença tratada, podem indicar recidiva tumoral, na maioria das vezes, hepática. Um novo tumor primário não pode ser detectado nessa situação e a investigação clínica adicional é indicada. Basicamente, pode-se inferir que aproximadamente 25% a 50% dos indivíduos com metástases locorregionais e 95% com metástases hepáticas têm níveis de CEA constantemente elevados.(16)
Todos os biomarcadores analisados apresentaram valores medianos na faixa de variação dos padrões referenciais. Além disso, não foi possível constatar a relação conjunta entre os valores do CEA com os demais marcadores bioquímicos (p>0,05), provavelmente em decorrência do reduzido n amostral.
CONCLUSÃO
A associação dos biomarcardores séricos (CEA, bilirrubinas e aminotransferases) não demonstrou resultados laboratoriais significativos. Entretanto, valores do CEA alterados não podem ser desconsiderados, pois, quando averiguados isoladamente, inferem um possível risco de desenvolvimento de neoplasias do sistema digestório, principalmente na região colorretal; assim como da mama, do pulmão e do ovário.
Agradecimentos
Aos pacientes e colaboradores do Hospital Barão de Lucena (HBL), Recife-PE, Brasil, pela permissão na aquisição dos prontuários para a realização da pesquisa.
Abstract
Objective: this research was based on the serum determination of important biological markers, in oncologic individuals, for a possible prognostic detection of colorectal cancer, such as CEA (carcinoembryonic antigen), aminotransferases (ALT and AST) and total bilirubin (TB) and its direct (DB) and indirect (IB) fractions. Methods: archived medical records from individuals (n=80), attended at the outpatient clinic and under hospitalization of the Barão de Lucena Hospital oncology sector, located in Recife, Pernambuco, Brazil, were cataloged for analysis. The cross-sectional cohort study was adopted to evaluate the prevalence of CEA positivity, correlated with elevated serum levels of bilirubins and aminotransferases. Results: the highest percentage of individuals with altered values, in each biological marker analyzed, corresponded to the male sex; with the major difference observed for IB (44,0% vs. 18,2%). The percentage of altered results for AST, TB, DB and IB was correspondingly higher among individuals that expressed altered CEA values; with the two major differences verified for TB (20.6% vs. 8.7%) and IB (35.3% vs. 19.6%). Conclusion: the association of serum biomarkers (CEA, bilirubins and aminotransferases) didn’t demonstrate significant results. However, altered CEA values shouldn’t be disregarded, because, when individually analyzed, infer a possible neoplasm development risk of the digestive system, mainly in the colorectal region, as well as of the breast, lung and ovary.
Keywords
Biological markers; Carcinoembryonic antigen; Bilirubin; Alanine transaminase; Aspartate aminotransferases
REFERÊNCIAS
- Simard JF, Ekberg S, Johansson AL, Askling J. What is the impact of chronic systemic inflammation such as rheumatoid arthritis on mortality following cancer? Ann Rheum Dis. 2016;75(5):862-6.
- Munhoz MP, Oliveira J, Gonçalves RD, Zambon TB, Oliveira LCN. Efeito do exercício físico e da nutrição na prevenção do câncer. Revista Odontológica de Araçatuba. 2016;37(2):9-16.
- Instituto Nacional de Câncer. Estimativa 2016: incidência de câncer no Brasil. Rio de Janeiro: INCA; 2015.
- Perera FP. Molecular epidemiology: insights into cancer susceptibility, risk assessment, and prevention. J Natl Cancer Inst. 1996;88(8):496-509.
- Pacheco FA, Paschoal MEM, Carvalho MGC. Marcadores tumorais no câncer de pulmão: um caminho para a terapia biológica. J Pneumol. 2002;28(3):143-9.
- Barrenechea JRC, Solís TH, Acevedo JLA. Antígeno carcinoembrionario en la recurrencia y sobrevida de pacientes con resección curativa de cáncer colorrectal. Anales de la Facultad de Medicina. 2014;75(2):137-43.
- Gomes CIMR, Furtado PCF, Silva CSF, Coelho M, Rocha DC, Coutinho FLS. Estudo sobre a acurácia da colonoscopia na detecção do câncer colorretal. Rev Méd Minas Gerais. 2013; 23(3): 307-10.
- Henry NL, Hayes DF. Cancer biomarkers. Mol Oncol. 2012;6:140-6.
- Miranda S, Chibante AMS, Dias RM. Valor da dosagem do antígeno carcinoembrionário no diagnóstico diferencial dos derrames pleurais. Pulmão RJ. 1996;2(2):78-80.
- Hoskovec D, Varga J, Konecná E, Antos F. Levels of CEA and Ca 19 – 9 in the sera and peritoneal cavity in patients with gastric and pancreatic cancers. Acta Cir Bras. 2012;27(6):410-6.
- Fletcher RH. Carcinoembryonic antigen. Ann Intern Med. 1986; 104(1):66-73.
- Mandorwski S, Lourenço LG, Forones NM. CA 72-4 e CEA no soro e no lavado peritoneal de doentes com câncer gástrico. Arq Gastroenterol. 2002;39(1):17-21.
- Malati T. Tumour markers: an overview. Indian J Clin Biochem. 2007;22(2):17-31.
- Lundin J, Roberts PJ, Kuusela P, Haglund C. The prognostic value of preoperative serum levels of CA 19-9 and CEA in patients with pancreatic cancer. Br J Cancer. 1994;69(3):515-9.
- Castro Júnior MAM, Rosemberg NP, Leuck Júnior I. Antígeno carcinoembrionário no diagnóstico diferencial dos derrames pleurais. Rev Col Bras Cir. 2005;32(1):15-7.
- Rocklin MS, Senagore AJ, Talbott TM. Role of carcinoembryonic antigen and liver function tests in the detection of recurrent colorectal carcinoma. Dis Colon Rectum. 1991;34(9):794-7.
- Temme EH, Zhang J, Schouten EG, Kesteloot H. Serum Bilirubin and 10-Year Mortality Risk in a Belgian Population. Cancer Causes Control. 2001;12(10):887-94.
- Zucker SD, Horn PS, Sherman KE. Serum bilirubin levels in the U.S. population: gender effect and inverse correlation with colorectal cancer. Hepatology. 2004;40(4):827-35.
- Ong KL, Allison MA, Cheung BM, Wu BJ, Barter PJ, Rye KA. The relationship between total bilirubin levels and total mortality in older adults: the United States National Health and Nutrition Examination Survey (NHANES) 1999-2004. PLoS One. 2014;9(4):e94479
- Telli EMRP, Frigeri M, Mello SR. Avaliação da atividade de enzimas hepáticas em dependentes, ex-dependentes e não usuários do etanol. RBAC. 2016;48(3):245-52.
- Al-Shaiba R, McMillan DC, Angerson WJ, Leen E, McArdle CS, Horgan P. The relationship between hypoalbuminaemia, tumour volume and the systemic inflammatory response in patients with colorectal liver metastases. Br J Cancer. 2004;919(2):205-7.
- Kim HC, Nam CM, Jee SH, Han KH, Oh DK, Suh I. Normal serum aminotransferase concentration and risk of mortality from liver diseases: prospective cohort study. BMJ. 2004;328(7446):983-9.
- Kunutsor SK, Apekey TA, Hemelrijck MV, Calori G, Perseghin G. Gamma glutamyltransferase, alanine aminotransferase and risk of cancer: Systematic review and meta-analysis. Int J Cancer. 2015;136(5):1162-70.
- Novakvic S, Sersa G, Krosl G, Plesnicar S. CEA, MCA e CA 125 tumor markers in pregnant women. Radiol Iugusl. 1990;24:79-84.
- Gervaz P, Blanchard A, Pampallona S, Mach JP, Fontolliet C, Gillet M. Prognostic value of postoperative carcinoembryonic antigen concentration and extent of invasion of resection margins after hepatic resection for colorectal metastases. Eur J Surg. 2000;166 (7):557-61.
- Dorrance HR, McGregor JR, McAllister EJ, O’Dwyer PJ. Bile carcinoembryonic antigen levels and occult hepatic metastases from colorectal cancer. Dis Colon Rectum. 2000;43(9):1292-96.
- Priolli DG, Cardinalli IA, Piovesan H, Margarido NF, Martinez CAR. Proposta para estadiamento do câncer colorretal baseada em critérios morfofuncionais. Correlação com níveis séricos do antígeno carcinoembrionário. Rev bras Coloproct, 2007;27(4): 374-83.
- Choi SR, Jang JS, Lee JH, Roh MH, Kim MC, Lee WS, Qureshi W. Role of serum tumor markers in monitoring for recurrence of gastric cancer following radical gastrectomy. Dig Dis Sci. 2006;51 (11):2081-6.
- Filiz AI, Sucullu I, Kurt Y, Karakas DO, Gulec B, Akin ML. Persistent high postoperative carcinoembryonic antigen in colorectal cancer patients – is it important? Clinics (São Paulo). 2009;64(4):287-94.
- Beddene L, Jouve JL. Monitoring colorectal cancer after surgical resection. Presse Med. 1999;28(18):651-6. [Article in French]
Correspondência
Ana Catarina Simonetti
Centro Universitário Tabosa de Almeida/Asces-Unita
Av. Portugal, nº 584, Bairro Universitário
55016-901 – Caruaru-PE, Brasil
