Resumos
OBJETIVO: Avaliar as complicações pós-operatórias imediatas de doadores vivos de lobos pulmonares para transplante. MÉTODOS: Entre setembro de 1999 e maio de 2005 foram realizadas lobectomias em 32 doadores saudáveis para transplante pulmonar em 16 receptores. Os prontuários médicos destes doadores foram analisados retrospectivamente para verificar a incidência de complicações pós-operatórias e as alterações da função pulmonar após a lobectomia. RESULTADOS: Vinte e dois doadores (68,75%) não apresentaram complicações. Entre os 10 casos que apresentaram alguma complicação o derrame pleural foi a mais freqüente, ocorrendo em 5 deles (15,6% da amostra). Três doadores (9,3%) necessitaram de transfusão de hemácias e, em 2 casos, foi necessária nova intervenção cirúrgica devido a hemotórax. Um doador apresentou pneumotórax após a retirada do dreno de tórax e houve um caso de infecção respiratória. Ocorreram duas intercorrências intra-operatórias (6,25%): em um doador foi realizada broncoplastia do lobo médio; em outro, foi necessária a ressecção da língula. Não houve mortalidade cirúrgica nesta série. As provas de função pulmonar do pós-operatório demonstraram uma redução média de 20% no volume expiratório forçado no primeiro segundo (p < 000,1), em comparação com os valores verificados antes da cirurgia. CONCLUSÕES: A lobectomia em doadores pulmonares vivos para transplante apresenta elevado risco de complicações pós-operatórias e resulta em perda definitiva da função pulmonar Uma cuidadosa avaliação pré-operatória faz-se necessária para reduzir a incidência de complicações nos doadores vivos de lobos pulmonares para transplante.
Transplante de pulmão; Doadores vivos; Pneumonectomia; Complicações pós-operatórias
OBJECTIVE: To evaluate post-operative complications in living lobar lung transplant donors. METHODS: Between September of 1999 and May of 2005, lobectomies were performed in 32 healthy lung transplant donors for 16 recipients. The medical charts of these donors were retrospectively analyzed in order to determine the incidence of postoperative complications and alterations in pulmonary function after lobectomy. RESULTS: Twenty-two donors (68.75%) presented no complications. Among the 10 donors presenting complications, the most frequently observed complication was pleural effusion, which occurred in 5 donors (15.6% of the sample). Red blood cell transfusion was necessary in 3 donors (9.3%), and 2 donors underwent a second surgical procedure due to hemothorax. One donor presented pneumothorax after chest tube removal, and one developed respiratory infection. There were two intra-operative complications (6.25%): one donor required bronchoplasty of the middle lobe; and another required lingular resection. No intra-operative mortality was observed. Post-operative pulmonary function tests demonstrated an average reduction of 20% in forced expiratory volume in one second (p < 000.1) compared to pre-operative values. CONCLUSIONS: Lobectomy in living lung transplant donors presents high risk of post-operative complications and irreversible impairment of pulmonary function. Careful pre-operative evaluation is necessary in order to reduce the incidence of complications in living lobar lung transplant donors.
Lung transplantation; Living donors; Pneumonectomy; Postoperative complications
ARTIGO ORIGINAL
Complicações relacionadas à lobectomia em doadores de transplante pulmonar intervivos* * Trabalho realizado no Pavilhão Pereira Filho Irmandade Santa Casa de Misericórdia de Porto Alegre ISCMPA Porto Alegre (RS) Brasil.
Spencer Marcantônio CamargoI; José de Jesus Peixoto CamargoII; Sadi Marcelo SchioIII; Leticia Beatriz SánchezIV; José Carlos FelicettiV; José da Silva MoreiraVI; Cristiano Feijó AndradeVII
ICirurgião Torácico do Grupo de Transplante Pulmonar. Irmandade Santa Casa de Misericórdia de Porto Alegre ISCMPA Porto Alegre (RS) Brasil
IIProfessor Adjunto de Cirurgia Torácica. Fundação Faculdade Federal de Ciências Médicas de Porto Alegre FFFCMPA Porto Alegre (RS) Brasil
IIIClínico do Grupo de Transplante Pulmonar. Irmandade Santa Casa de Misericórdia de Porto Alegre ISCMPA Porto Alegre (RS) Brasil
IVPneumologista do Grupo de Transplante Pulmonar. Irmandade Santa Casa de Misericórdia de Porto Alegre ISCMPA Porto Alegre (RS) Brasil
VProfessor Assitente de Cirurgia Torácica. Fundação Faculdade Federal de Ciências Médicas de Porto Alegre FFFCMPA Porto Alegre (RS) Brasil
VIProfessor Adjunto de Pneumologia da Universidade Federal do Rio Grande do Sul UFRGS Porto Alegre (RS) Brasil
VIICirurgião Torácico. Hospital da Criança Santo Antônio, Porto Alegre (RS) Brasil
Endereço para correspondência Endereço para correspondência: Cristiano Feijó Andrade Santa Casa de Porto Alegre, Hospital da Criança Santo Antônio Av. Independência, 155, 3º andar, Centro CEP 90020-090, Porto Alegre, RS, Brasil Tel 55 51 32148674 E-mail: cristianofa@cirurgiatoracica.net
RESUMO
OBJETIVO: Avaliar as complicações pós-operatórias imediatas de doadores vivos de lobos pulmonares para transplante.
MÉTODOS: Entre setembro de 1999 e maio de 2005 foram realizadas lobectomias em 32 doadores saudáveis para transplante pulmonar em 16 receptores. Os prontuários médicos destes doadores foram analisados retrospectivamente para verificar a incidência de complicações pós-operatórias e as alterações da função pulmonar após a lobectomia.
RESULTADOS: Vinte e dois doadores (68,75%) não apresentaram complicações. Entre os 10 casos que apresentaram alguma complicação o derrame pleural foi a mais freqüente, ocorrendo em 5 deles (15,6% da amostra). Três doadores (9,3%) necessitaram de transfusão de hemácias e, em 2 casos, foi necessária nova intervenção cirúrgica devido a hemotórax. Um doador apresentou pneumotórax após a retirada do dreno de tórax e houve um caso de infecção respiratória. Ocorreram duas intercorrências intra-operatórias (6,25%): em um doador foi realizada broncoplastia do lobo médio; em outro, foi necessária a ressecção da língula. Não houve mortalidade cirúrgica nesta série. As provas de função pulmonar do pós-operatório demonstraram uma redução média de 20% no volume expiratório forçado no primeiro segundo (p < 000,1), em comparação com os valores verificados antes da cirurgia.
CONCLUSÕES: A lobectomia em doadores pulmonares vivos para transplante apresenta elevado risco de complicações pós-operatórias e resulta em perda definitiva da função pulmonar Uma cuidadosa avaliação pré-operatória faz-se necessária para reduzir a incidência de complicações nos doadores vivos de lobos pulmonares para transplante.
Descritores: Transplante de pulmão; Doadores vivos; Pneumonectomia; Complicações pós-operatórias.
Introdução
A utilização de doadores vivos para a realização de transplantes pulmonares é uma alternativa frente à escassez de doadores cadavéricos e à alta mortalidade dos pacientes que aguardam em lista para transplantes.
Desde a realização do primeiro transplante pulmonar isolado com sucesso,(1) as indicações e o número de pacientes em lista de espera para transplante pulmonar têm aumentado progressivamente. Entretanto, não há um aumento, na mesma proporção, no número de doadores cadavéricos. Esta diferença entre o número de doadores e de receptores faz com que ocorra uma maior chance de óbito para um paciente em lista de espera de transplante pulmonar do que a de receber um pulmão viável.(2) Como uma alternativa a esta dificuldade de obtenção de órgãos cadavéricos viáveis, surgiu a possibilidade de utilização de órgãos de doadores vivos.(3) Com esta nova fonte de órgãos tem-se observado um aumento no número de transplantes de rim, fígado e pulmão, que no caso dos transplantes renais, já corresponde a mais de 50% dos procedimentos realizados anualmente.(4-5) Particularmente, o uso de doadores vivos para os diferentes tipos de transplantes cria uma situação única na medicina, na qual o tratamento de um paciente com doença avançada também expõe um indivíduo saudável (o doador) a um risco considerável de morbi-mortalidade.(6-7) Recentemente, esta situação tem sido discutida amplamente na literatura, principalmente após a divulgação de mortes entre doadores vivos para transplantes renais e hepáticos.(8)
Em 1992 foi descrita, pela primeira vez, a utilização de lobos pulmonares de doadores vivos para transplante em duas crianças portadoras de doença pulmonar terminal.(3) A partir daí, prosseguiu-se a utilização de doadores vivos no transplante pulmonar, estimulado principalmente, pela alta mortalidade de pacientes em lista de espera devido à escassez de doadores cadavéricos.(9) Atualmente, esta modalidade de tratamento vem sendo empregada em diversos centros como uma alternativa eficaz para pacientes com doença progressiva, que possivelmente sucumbiriam durante a espera por um doador cadavérico compatível.(10-15) Como particularidade desta técnica, existe a necessidade da utilização de 2 doadores saudáveis, de preferência familiares, compatíveis com o receptor quanto ao grupo sanguíneo e ao tamanho do órgão para a realização do transplante.(9) Cada um destes indivíduos será submetido à ressecção de um lobo de um dos pulmões, o que lhes acarretará uma perda funcional definitiva. Na literatura existem poucos relatos a respeito das complicações e evolução desses doadores, sendo descrita uma morbidade relativamente elevada, todavia sem mortalidade.(6-7) O presente trabalho é o primeiro da literatura brasileira com o objetivo de demonstrar os resultados e dificuldades encontradas por um grupo de transplante pulmonar no manejo de doadores vivos de lobos pulmonares para transplante.
Métodos
Este trabalho foi aprovado pelo Comitê de Ética em Pesquisa da Irmandade Santa Casa de Misericórdia de Porto Alegre, sob o protocolo nº 1.114/05.
Entre setembro de 1999 e maio de 2005 foram realizados 32 lobectomias para transplante pulmonar intervivos em 16 receptores. As cirurgias foram realizadas no Pavilhão Pereira Filho da Santa Casa de Misericórdia de Porto Alegre. Todos os 32 doadores tiveram seus prontuários com os registros cirúrgicos e anestésicos analisados. Vinte e oito doadores (87,5%) foram acompanhados após a alta hospitalar, por um período de 10 a 78 meses (média de 36 meses). Quatro doadores foram perdidos de acompanhamento por mudança de endereço. O acompanhamento era realizado através de visitas periódicas ou por contato telefônico, mesmo nos casos em que houve insucesso e óbito do receptor. Cerca de 60 dias após a cirurgia os doadores foram reavaliados com novos radiogramas de tórax. Uma espirometria pós-operatória foi realizada no grupo de 28 doadores em um período variável de 3 a 68 meses (média de 27 meses com mediana de 24 meses).
Dezesseis pacientes com idades entre 6 e 29 anos (média de 12,4 anos) foram submetidos a transplante pulmonar lobar bilateral. Os receptores foram avaliados por uma equipe multidisciplinar composta de psicólogos, nutricionistas, fisioterapeutas, assistentes sociais, médicos pneumologistas e intensivistas da equipe de transplantes, sendo indicado o transplante para os pacientes nos quais a doença encontrava-se em estágio avançado e com poucas chances de aguardar o aparecimento de um doador cadavérico compatível. As doenças que indicaram o transplante foram: fibrose cística (8 casos) e bronquiolite obliterante (8 casos). Todos os receptores estavam em uso de oxigênio suplementar no momento da indicação do transplante, e não houve casos de re-transplante neste grupo.
Os potenciais doadores foram avaliados inicialmente quanto à tipagem sanguínea e ao tamanho do pulmão em relação ao receptor. Todos os potenciais doadores avaliados eram familiares relacionados aos receptores. Os doadores compatíveis foram submetidos à avaliação pela equipe multidisciplinar e receberam informações sobre o procedimento e riscos de morbi-mortalidade envolvida. No caso de doadores menores de idade, situação de 3 doadores (9,3%), foi obtida autorização junto ao juizado de menores.
Os doadores selecionados foram então avaliados clinicamente e realizaram radiogramas simples e tomografia computadorizada de tórax com volumetria dos lobos inferiores, eletrocardiograma e ecodopplercardiograma, provas de função renal e hepática, sorologia e avaliação funcional pulmonar com espirometria.(16-18) Em todos os doadores foi previamente realizada fibrobroncoscopia para estudo da árvore brônquica, o que, em um caso, foi determinante na escolha do lado da lobectomia. Nos primeiros 10 transplantes também foram realizadas arteriografias pulmonares dos doadores no lado escolhido para a lobectomia, buscando-se, assim, identificar alterações na origem das artérias segmentares que trouxessem dificuldades durante a cirurgia. Posteriormente, este exame foi abandonado porque, mesmo sendo de boa qualidade, nem sempre era possível a identificação dos ramos arteriais em situação desfavorável, além de acrescentar morbidade aos doadores.
Quando não havia contra-indicações para a doação, a escolha dos doadores era formalizada.
Sendo a anatomia de ambos os brônquios lobares inferiores favorável, a escolha do lado da lobectomia de cada doador era feita com base no tamanho do pulmão dos doadores em relação ao receptor, utilizando-se, para isto, a medida das volumetrias dos lobos pulmonares dos doadores comparados com a dos pulmões dos receptores. A história prévia de doença ou trauma de tórax em algum dos lados também foi fator decisivo na escolha do lado da lobectomia.(16,17) A Tabela 1 resume os dados referentes aos 32 doadores.
As lobectomias foram efetuadas no mesmo bloco cirúrgico onde se encontrava o receptor, iniciando-se pela retirada do lobo compatível com o lado em que o pulmão do receptor apresentasse a menor perfusão, medida previamente por cintilografia. Isto permitia que o implante do primeiro lobo fosse realizado, na maioria dos casos, sem o uso de circulação extracorpórea. Enquanto o implante do primeiro lobo era efetuado, uma outra equipe iniciava a lobectomia no segundo doador.
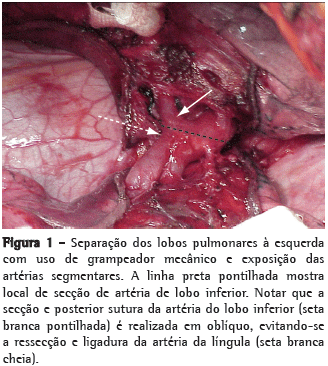
A técnica cirúrgica utilizada na lobectomia dos doadores foi descrita inicialmente por Starnes et al.(9) Os doadores eram anestesiados e intubados com tubos de duplo lúmen para ventilação monopulmonar. Cateteres peridurais para analgesia pós-operatória foram colocados em todos os doadores, seguido por uma toracotomia póstero-lateral. Após a inspeção da cavidade e liberação do ligamento pulmonar, o pericárdio era aberto para permitir a exposição da veia pulmonar inferior junto com uma margem de músculo atrial esquerdo. As cissuras, quando incompletas, foram liberadas com utilização de grampeadores mecânicos, permitindo a abordagem da artéria pulmonar e dissecção da artéria lobar inferior, com especial atenção para os ramos do segmento superior e lobo médio à direita, bem como para os ramos da artéria da língula à esquerda (Figura 1). Após a dissecção dos vasos e do brônquio, os doadores recebiam uma dose de 5000 UI de heparina intravenosa. Após 3 min de ventilação pulmonar, eram colocados clampes vasculares na artéria pulmonar inferior e no átrio esquerdo, mantendo uma margem distal adequada para a posterior anastomose no átrio esquerdo do receptor. Após a divisão da artéria e da veia pulmonar inferior, o brônquio lobar inferior era dividido. A secção do brônquio era realizada sem clampeamento, requerendo-se atenção para que não ocorresse comprometimento do brônquio do lobo médio, deixando-se ao mesmo tempo, uma margem mínima distal; evitou-se, assim, a separação dos brônquios do segmento superior e pirâmide basal, para que não comprometesse a anastomose no brônquio do receptor. A realização da broncotomia de forma oblíqua normalmente permite uma adequada margem para o fechamento do coto brônquico proximal, sem comprometer a margem distal para a anastomose no receptor.
Terminada a lobectomia, o lobo era colocado em uma bacia imerso em solução fisiológica gelada e ventilado com oxigênio a 100% através de um tubo traqueal infantil, recebendo, ao mesmo tempo, a infusão de 2 L de solução de preservação pulmonar (Perfadex®, Vitrolife, Kungsbacka Suécia), administrada inicialmente por via anterógrada (artéria pulmonar) e, posteriormente, por via retrógrada (veias pulmonares), utilizando-se uma cânula arterial delicada. A preservação era considerada ideal quando a solução drenada ficava clara e o parênquima assumia uma coloração homogeneamente esbranquiçada (Figuras 2a e 2b). A sutura de fechamento das artérias pulmonares dos doadores era realizada com fio prolene 6-0 (Prolene®, Ethicon, Johnson & Johnson, Cincinnati, OH, EUA) e do átrio esquerdo com prolene 5-0, ambas de modo contínuo. Os brônquios eram fechados com fio prolene 4-0, com pontos separados. Por fim, as toracotomias eram fechadas deixando-se 2 drenos pleurais, e os doadores eram encaminhados já extubados para a recuperação na unidade de terapia intensiva.
Todos os dados foram armazenados em planilha eletrônica (Microsoft Excel®). O teste t de Student foi utilizado para comparações entre os grupos que realizaram espirometria no pré e pós-operatório. Os dados estão representados como média ± desvio padrão da média. A significância estatística foi considerada para p < 0,05.
Resultados
Dezesseis pacientes foram submetidos ao transplante lobar bilateral. Destes, 10 tiveram boa recuperação e alta hospitalar em boas condições. Ocorreram 6 óbitos no período do pós-operatório imediato, sendo 4 por falência aguda do órgão e 2 por sepse. Um paciente foi ao óbito 15 meses após o transplante por infecção generalizada, após ter apresentado intolerância grave aos imunossupressores. A sobrevida em um ano foi de 62,5%, e de 56% em três anos.
Dos 32 doadores de lobo para transplante, 22 (68,7%) não apresentaram complicações. O tempo médio de permanência hospitalar foi de 6,7 dias e o tempo médio de permanência com dreno de tórax de 3,25 dias. Dos 10 doadores que apresentaram alguma complicação, 5 foram doadores de lobo inferior direito e 5 de lobo inferior esquerdo. Não houve sangramento importante durante as cirurgias (média de 127 mL) nem necessidade de transfusão intra-operatória. Não houve mortalidade. No intra-operatório ocorreram duas intercorrências. Em um caso, foi ligada a artéria da língula para permitir uma margem suficiente para anastomose da artéria lobar inferior no receptor. No outro caso, não havia margem suficiente para o fechamento do coto do brônquio lobar inferior sem comprometer o brônquio do lobo médio. O mesmo foi seccionado e re-inserido no brônquio intermediário. Três doadores (9,37%) necessitaram de transfusão de sangue no Centro de Tratamento Intensivo devido a sangramento pelo dreno de tórax. Destes, 2 necessitaram de nova intervenção cirúrgica no quinto dia pós-operatório por apresentarem coágulo pleural retido, sendo realizadas videotoracoscopias com evacuação do coágulo e lavagem da cavidade. Uma outra doadora apresentou dispnéia súbita no oitavo dia de pós-operatório sendo diagnosticado um pneumotórax no lado da lobectomia. Foi inserido um dreno pleural com re-expansão pulmonar completa. A paciente permaneceu com o dreno por três dias e, antes da sua retirada, o brônquio foi reavaliado através de fibrobroncoscopia, sem evidência de fístula.
As demais complicações ocorridas neste grupo de doadores foram 5 derrames pleurais (15,6%): 3 foram manejados de forma conservadora; nos outros 2 casos foi necessária a realização de toracocentese de alívio por queixa de dispnéia. Uma doadora apresentou febre e imagem radiológica de consolidação pulmonar enquanto internada, sendo tratada com antibioticoterapia endovenosa (ampicilina e sulbactam). Em um único caso foi necessária a manutenção do dreno pleural por mais de sete dias devido à persistência de escape aéreo, sendo este retirado no nono dia pós-operatório. Não houve nenhum caso de fistula brônquica ou empiema no pós-operatório imediato ou tardio.
As provas de função pulmonar pós-operatórias efetuadas em 28 doadores mostraram uma diminuição significativa média de 20% (intervalo de 3 a 40%) no volume expiratório forçado no primeiro segundo (VEF1) e na capacidade vital forçada de 17%, em relação ao valor verificado no pré-operatório (Tabela 2). Após 90 dias da lobectomia todos os doadores relataram ter voltado a exercer as atividades que realizavam antes da cirurgia. Nos radiogramas de tórax, não foram evidenciadas outras alterações além daquelas já esperadas para as ressecções pulmonares correspondentes.
Discussão
A utilização de doadores vivos para a realização de transplantes vem aumentando anualmente, principalmente nos transplantes renais e hepáticos. A principal crítica a esta modalidade de tratamento é a exposição de um indivíduo saudável, o doador, a um risco de morbi-mortalidade que não pode ser desprezado. Em uma revisão de 16.395 doadores de rins e fígados reportado pela United Network of Organ Sharing,(8) ocorreram 2 óbitos de doadores renais e um óbito de doador hepático, além de 2 doadores de fígado que precisaram ser encaminhados para a lista de espera para transplante hepático.
A situação do transplante pulmonar com doador vivo é ainda incipiente se comparada, principalmente, ao transplante renal, em que na metade dos procedimentos realizados são utilizados doadores vivos.(4) No caso do transplante pulmonar intervivos, este procedimento apresenta-se como uma opção viável para receptores com doença em evolução rápida e sem perspectiva de espera de um órgão de doador cadavérico em tempo hábil.
Para o transplante pulmonar é necessária a utilização de 2 doadores para um receptor, tornando este tipo de transplante uma situação única em matéria de transplante de órgãos. Na literatura, as complicações em doadores de lobos pulmonares para transplante estão relacionadas a uma morbidade variável entre 19,8 e 61,3%,(6,7,15,19) incluindo desde complicações menores como derrames pleurais e atelectasias até complicações mais graves como fistulas brônquicas e fibrilação atrial, necessitando a implantação de marca-passo. Até o presente momento não houve nenhum caso de morte relatado em doadores pulmonares em transplantes intervivos.
É importante que os familiares selecionados para a doação sejam cuidadosamente avaliados em uma entrevista com médicos e psicólogo, fazendo-os cientes dos riscos envolvidos e, principalmente, buscando-se identificar qualquer possível pressão por outros membros da família que crie uma situação em que a doação não seja absolutamente espontânea e altruísta. Nestes casos, a utilização deste doador deve ser excluída por uma justificativa unicamente médica, favorecendo a união familiar.
A lobectomia, como tradicionalmente realizada para tratamento de doenças neoplásicas e inflamatórias, não é um procedimento isento de morbi-mortalidade.(20-22) Complicações relacionadas a fístulas brônquicas são mais freqüentemente encontradas em pneumonectomias, mas também podem ocorrer em lobectomias.(22-24) Persistência de fuga aérea por mais de sete dias ocorre em cerca de 15% das ressecções pulmonares,(22,25) e a ocorrência de um derrame pleural pequeno na base da cavidade é freqüente após lobectomias, podendo, na maioria das vezes, ser manejado de forma conservadora.(26)
Quando comparado à lobectomia convencional para o tratamento de neoplasias pulmonares, a lobectomia no doador envolve algumas particularidades que representam um risco aumentado de complicações.(6) Na lobectomia para a utilização do lobo pulmonar para transplante, as estruturas vasculares e o brônquio devem ser ressecados com uma margem distal adequada que permita o implante no receptor sem comprometer o brônquio e vascularização do pulmão remanescente do doador.(6) Isto implica na dissecção proximal das estruturas, deixando-se uma margem menor para o fechamento da artéria e do brônquio, favorecendo então as pequenas lesões alveolares junto às cissuras; isto, muitas vezes, pode ser responsável pelo escape aéreo prolongado. Levando-se em conta a possibilidade do brônquio do lobo médio originar-se em oposição ao brônquio do segmento superior, algumas vezes a margem brônquica distal só é possível com a amputação do brônquio lobar médio, e quando possível, o mesmo é re-inserido no brônquio intermediário; caso contrário, necessita ser retirado.(6,7) Em apenas um caso da presente série foi necessária a realização de broncoplastia do lobo médio, não havendo necessidade de bi-lobectomia em nenhum doador, o que pode ocorrer em até 1,5% dos casos.(6,7) Outras complicações descritas como fístula brônquica, empiema ou arritmia grave, não foram observadas nesta série.(6) Os cuidados em não avançar demais com o clampe vascular no átrio esquerdo no momento de seccionar a veia pulmonar e o fechamento do coto brônquico sem desvascularização demasiada podem ter contribuído para evitar estas complicações.
A ocorrência de complicações maiores ou menores nos 10 doadores (31,25%) desta série foi maior do que a encontrada por Bowdish et al. (19,8%)(7) e menor do que as descritas por Bataffarano et al. (61,3%),(6) e comparável aos índices relatados na literatura(20,21) e no próprio serviço(22) para as ressecções pulmonares rotineiramente realizadas com outras finalidades.
Não foram detectadas diferenças no número ou gravidade das complicações em relação ao lado da lobectomia, o que foi uma variável estatisticamente significativa encontrada por Bowdish et al.,(7) e pode ser explicada pelas diferenças anatômicas relacionadas principalmente com a posição do brônquio do lobo médio. Na série estudada, ocorreram 5 complicações em doadores de lobos à direita e 5 à esquerda, com semelhança em relação aos tipos de complicações.
Os resultados quanto à sobrevida dos receptores de lobos pulmonares, relatados pelos principais grupos que realizam o transplante pulmonar intervivos, mostram uma sobrevida variável entre e 63,7 e 70% no primeiro ano e de 54% em três anos,(6,11) números semelhantes aos encontrados neste grupo estudado de 16 receptores.
A série estudada é a primeira descrita com este tipo de transplante efetuado no Brasil. O número de casos ainda é pequeno e uma melhor apreciação dos resultados, com maior consistência, só será alcançada com o acompanhamento a longo prazo de um número maior de casos. Nesta série, foi observado que a lobectomia em doadores pulmonares vivos para transplante apresenta elevado risco de complicações pós-operatórias e resulta em perda definitiva da função pulmonar Se isto implicará em complicações futuras, somente o seguimento destes indivíduos por um período maior de tempo poderá esclarecer.
Recebido para publicação em 13/05/2007
Aprovado, após revisão, em 6/8/2007
- 1. Unilateral lung transplantation for pulmonary fibrosis. Toronto Lung Transplant Group. N Engl J Med. 1986;314(18):1140-5.
- 2. Langone AJ, Helderman JH. Disparity between solid-organ supply and demand. N Engl J Med. 2003;349(7):704-6.
- 3. Starnes VA, Lewiston NJ, Luikart H, Theodore J, Stinson EB, Shumway NE. Current trends in lung transplantation. Lobar transplantation and expanded use of single lungs. J Thorac Cardiovasc Surg. 1992;104(4):1060-5; discussion 1065-6.
- 4. Nathan HM, Conrad SL, Held PJ, McCullough KP, Pietroski RE, Siminoff LA, et al. Organ donation in the United States. Am J Transplant. 2003;3 Suppl 4:29-40.
-
5ABTO - Associação Brasileira de Transplante de Órgãos [homepage on the Internet]. São Paulo: Associação Brasileira de Transplante de Órgãos. [cited 2007 May 13] Registro Brasileiro de Transplantes - Ano XI nº2. Available from http://abto.org.br/profissionais/rbt/anoXI_n2/RBT_ANO_XI_N2_final.pdf
- 6. Battafarano RJ, Anderson RC, Meyers BF, Guthrie TJ, Schuller D, Cooper JD, et al. Perioperative complications after living donor lobectomy. J Thorac Cardiovasc Surg. 2000;120(5):909-15.
- 7. Bowdish ME, Barr ML, Schenkel FA, Woo MS, Bremner RM, Horn MV, et al. A decade of living lobar lung transplantation: perioperative complications after 253 donor lobectomies. Am J Transplant. 2004;4(8):1283-8.
- 8. Ellison MD, Mc Bride MA, Edwards LB, Taranto SE, Barr ML, Trotter JF, et al. Living organ donation: mortality and early complications among 16,395 living donors in the U.S [abstract]. Am J Transplant. 2003;3(Suppl 5):283.
- 9. Starnes VA, Barr ML, Cohen RG. Lobar transplantation. Indications, technique, and outcome. J Thorac Cardiovasc Surg. 1994;108(3):403-10; discussion 410-1.
- 10. Starnes VA, Barr ML, Cohen RG, Hagen JA, Wells WJ, Horn MV, et al. Living-donor lobar lung transplantation experience: intermediate results. J Thorac Cardiovasc Surg. 1996;112(5):1284-90; discussion 1290-1.
- 11. Starnes VA, Bowdish ME, Woo MS, Barbers RG, Schenkel FA, Horn MV, et al. A decade of living lobar lung transplantation: recipient outcomes. J Thorac Cardiovasc Surg. 2004;127(1):114-22.
- 12. Bowdish ME, Pessotto R, Barbers RG, Schenkel FA, Starnes VA, Barr ML. Long-term pulmonary function after living-donor lobar lung transplantation in adults. Ann Thorac Surg. 2005;79(2):418-25.
- 13. Mendeloff EN, Huddleston CB, Mallory GB, Trulock EP, Cohen AH, Sweet SC, et al. Pediatric and adult lung transplantation for cystic fibrosis. J Thorac Cardiovasc Surg. 1998;115(2):404-13; discussion 413-4.
- 14. Camargo JJ; Grupo de Transplante Pulmonar da Santa Casa de Porto Alegre, RS, Brasil. [Lung transplant in children] [Article in Portuguese]. J Pediatr (Rio J). 2002;78(Suppl 2):S113-22.
- 15. Date H, Aoe M, Nagahiro I, Sano Y, Andou A, Matsubara H, et al. Living-donor lobar lung transplantation for various lung diseases. J Thorac Cardiovasc Surg. 2003;126(2):476-81.
- 16. Bowdish ME, Barr ML. Living lobar lung transplantation. Respir Care Clin N Am. 2004;10(4):563-79.
- 17. Watson TJ, Starnes VA. Pediatric lobar lung transplantation. Semin Thorac Cardiovasc Surg. 1996;8(3):313-25.
- 18. Schenkel FA, Horn MV, Woo MS, Barr ML, Starnes VA. Screening potential donors for living lobar lung transplantation. J Heart Lung Transplant. 2003;22(suppl. 1):S86-S87.
- 19. Prager LM, Wain JC, Roberts DH, Ginns LC. Medical and psychologic outcome of living lobar lung transplant donors. J Heart Lung Transplant. 2006;25(10):1206-12.
- 20. Stéphan F, Boucheseiche S, Hollande J, Flahault A, Cheffi A, Bazelly B, et al. Pulmonary complications following lung resection: a comprehensive analysis of incidence and possible risk factors. Chest. 2000;118(5):1263-70.
- 21. Deslauriers J, Ginsberg RJ, Piantadosi S, Fournier B. Prospective assessment of 30-day operative morbidity for surgical resections in lung cancer. Chest. 1994;106(6 Suppl):329S-330S.
- 22. Sanchez PG, Vendrame GS, Madke GR, Pilla ES, Camargo JJ, Andrade CF, et al Lobectomy for treating bronchial carcinoma: analysis of comorbidities and their impact on postoperative morbidity and mortality. J Bras Pneumol. 2006;32(6):495-504.
- 23. Vester SR, Faber LP, Kittle CF, Warren WH, Jensik RJ. Bronchopleural fistula after stapled closure of bronchus. Ann Thorac Surg. 1991;52(6):1253-7; discussion 1257-8.
- 24. Asamura H, Naruke T, Tsuchiya R, Goya T, Kondo H, Suemasu K. Bronchopleural fistulas associated with lung cancer operations. Univariate and multivariate analysis of risk factors, management, and outcome. J Thorac Cardiovasc Surg. 1992;104(5):1456-64.
- 25. Rice TW, Okereke IC, Blackstone EH. Persistent air-leak following pulmonary resection. Chest Surg Clin N Am. 2002;12(3):529-39.
- 26. Ponn RB. Complications of Pulmonary Resection. In: Shields TW, LoCicero J, Ponn RB, Rusch VW, editors. General Thoracic Surgery. 6th ed. Philadelphia: Lippincott Williams & Wilkins; 2004. p. 554-86.
Datas de Publicação
-
Publicação nesta coleção
02 Jun 2008 -
Data do Fascículo
Maio 2008
Histórico
-
Aceito
06 Ago 2007 -
Recebido
13 Maio 2007