1. 引言
顺铂为顺-二胺二氯铂(cisplatin,简称cis-DDP),是一种常见的化疗药物。此类含铂的抗癌药物可于活体内参与反应或键结,造成DNA交联(DNA crosslink),阻碍DNA复制与合成,最后引起细胞凋亡(apoptosis) [1]。目前顺铂是最广泛使用的化疗药物,可应用于子宫颈癌、头颈癌、食道癌等。然而,顺铂的使用也造成许多副作用,例如恶心、呕吐、神经毒等。其中,最严重也最受关注的是顺铂造成的肾毒性 [2]。
顺铂可激活Fas和肿瘤坏死因子-α (TNF-α)等死亡受体,调控下游的半胱氨酸蛋白酶(caspases),促使肾细胞坏死。顺铂亦可激活有丝分裂原活化蛋白(mitogen-activated protein kinase, MAPK),影响粒线体功能与细胞凋亡 [3]。除了以不同机制引起细胞死亡,顺铂也会提升肾脏的氧化压力与发炎反应 [4] [5]。目前临床上已尝试各种不同方法来减缓顺铂引起的肾毒性 [6] [7]。包含使用抗氧化剂、抗炎剂、或抗细胞凋亡的药物等,来达到减缓肾脏的损伤 [8] [9] [10]。然而这些制剂多半作用机制单一,仅可舒缓部分肾脏损伤,应考虑多重机制的肾保护方法。
目前已有研究发现特定食物可预防肾病发生 [11]。例如绿茶内的多酚可减缓老鼠因顺铂引起的急性肾损伤(acute kidney injury, AKI);又如菇类、芹菜等亦被研究出具有保护肾脏的作用 [12] [13] [14]。另外,近期也有研究益生菌(probiotics)或其代谢物(postbiotics)对于肾脏保护的效果 [15]。益生菌是指对人体有益的细菌,一般常见的益生菌为乳酸菌(lactic acid bacteria),长存于人体肠道中,其可以代谢产生不同的物质,提供人体所需的养分 [16]。部分益生菌可以抑制病原菌,或刺激其他有益菌,维持肠道菌相平衡与健康 [17] [18]。不同菌种(species)的益生菌,其对人体的作用也不同,而此差异还可细分至菌株(strain),故透过筛选益生菌在肾保护的作用有其必要性 [19]。
本研究自常见食物中分离不同菌株之乳酸菌后,利用单一剂量的顺铂刺激小鼠诱发AKI [20]。观察先于预防性喂食不同之乳酸菌,其对肾脏保护的效果,借此筛选出具肾脏保护的益生菌。
2. 材料与方法
2.1. 菌株分离与鉴定
取样自桑葚、山药、黑豆、母乳等不同可食用之动、植物来源的素材,以无菌水序列稀释后均匀涂抹于乳酸菌选择性MRS琼脂培养基上,于温度37℃培养48小时。待菌落生成,挑选形状或大小不一样的单一菌落,分别接种于20 ml的MRS肉汤培养基(BD Difco™ Lactobacilli MRS Broth, NJ, USA) 37℃培养16小时后,取部分菌液以API细菌鉴定套组(API® 50 CH, CMP, Taipei, Taiwan)确认其菌种,使用方法参考厂商使用手册。剩下培养液加入甘油,使甘油最终浓度约5%~10%,存放于−80℃,作为后续实验制备的种菌。
2.2. 菌株基本特性分析
分离之菌株进行基本特性分析,包含耐酸性试验与耐胆盐试验。1) 耐酸性试验:菌株自种菌活化两次至MRS肉汤培养基37℃培养16小时后,接种于pH 2.4的MRS肉汤培养基,以平板计数法(plate count method)分别计算0分钟与60分钟后的菌数,以百分比(%)表示乳酸菌的存活率:(接种菌数 − 存活菌数)/接种菌数,即其耐酸程度。2) 耐胆盐试验:菌株自种菌活化两次至MRS肉汤培养基37℃培养16小时后,接种于含0.3%胆盐(bile salt)的MRS肉汤培养基,以平板计数法(plate count method)分别计算0分钟与60分钟后的菌数,以百分比(%)表示乳酸菌的存活率:(接种菌数 − 存活菌数)/接种菌数,即其耐胆盐程度。
2.3. 菌株培养与制备
种菌先于MRS肉汤培养基活化两次后,接种5 ml于内含500 ml的MRS之2L摇瓶,静置37℃培养16小时后,以转速13,000 rpm离心10分钟,收集菌泥,并混入5%脱脂奶粉,先于−30℃冷冻24小时,再进行干操,获取菌粉。菌粉所含活菌数以平板计数法计算,并调整每只菌之活菌数约为1 × 1011 CFU/g。菌粉皆保存于4℃,供后续动物实验使用。
2.4. 实验动物饲养
雄性ICR小鼠,SPF级,共80只购自乐斯科生物科技股份有限公司(BioLasco Taiwan Co., Taipei, Taiwan)。动物饲养条件符合实验动物3R原则,小鼠自由饮食饮水,于室温24℃ ± 1℃,湿度55%~65%,明暗交替12 h的环境中适应性饲养,每天更换垫料,适应性饲养1周。
2.5. 动物实验设计
试验动物分成8组,每组10只,分别为正常组(normal)、顺铂诱导组(cisplatin)、正对照–药物处理组(amifostine)、以及乳酸菌处理分别5组。试验开始前,先秤其动物体重。试验第1至14天每日管喂小鼠乳酸菌500 mg/kg b.w.,正常组、顺铂诱导组、与药物处理组则以RO水代替。于第11天时,除了正常组外,其余所有组别皆以注射方式给予一剂20 mg/kg b.w.的顺铂,引发急性肾损伤,并于第14天称其体重后牺牲老鼠,取其肾脏称重,并收取血清与肾脏组织。药物处理组则在注射顺铂前30分钟,先注射200 mg/kg b.w.的氨磷汀(amifostine)。
2.6. 血清生化分析
收集老鼠血液于4℃以2000 xg离心15分钟,可暂时保存于−20℃待分析使用。血清中的血清尿素氮和肌酸酐以市售检测套组(Randox Laboratories Ltd., Antrim, UK)搭配生化分析仪(Roche Diagnostics, Cobas Mira Plus, Germany)测定。
2.7. 组织切片病理评分
肾脏组织以10%福尔马林缓冲液固定后,包埋在石蜡中,并切为约5 μm厚度之样品。将切片样品置于载玻片上,以苏木精-伊红染色(hematoxylin and eosin stain, H&E stain),于光学显微镜400×下观察组织。肾脏组织病里评分依据Shackelford等人研究定义,以组织病变面积<1%为1分、轻微2分(1%~25%)、中度3分(26%~50%)、中度严重4分(51%~75%)、以及最严重5分(76%~100%),并由专业兽医师判定 [21]。此次针对组织坏死(necrosis)与Tamm-Horsfall蛋白为基质之透明圆柱体(hyaline cast)的状况判定肾组织的健康程度。
2.8. 统计分析
使用Microsoft Excel 2010整理数据,图表数据皆以平均值(mean) ± 标准偏差(SD)表示,以Student’s t-test进行统计差异分析。统计p < 0.05表示具显著性差异。
3. 结果
3.1. 分离菌株之API鉴定
分别自动、植物可食用之素材来源共分离5株乳酸菌,经API鉴定结果有菌种Lactobacillus rhamnosus、L. plantarum、L. salivarius、以及L. fermentum。分别给予菌株代码如图1,除了L. plantarum GKM3和L. salivarius GKLF3外,其余菌株鉴别度约有95%以上。
3.2. 分离菌株之基本特性
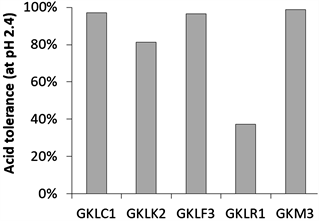
作为益生菌潜力之特性,需有耐胃酸与耐胆盐的能力,较能在未来应用中达到人体肠胃道作用。本实验的5株分离株,除了菌株GKLR1耐酸程度较低外,其余4株皆有80%以上的菌株存活率,又以GKLC1、GKLF3、GKM3为佳(图2(a))。耐胆盐上,菌株GKLK2和GKLR1表现效果相对差,以GKLC1、GKLF3为最佳(图2(b))。
 (a)
(a)  (b)
(b)
Figure 2. Basic characteristics of isolated lactic acid bacteria: (a) Acid tolerance; (b) Bile salt tolerance
图2. 分离之乳酸菌基本特性:(a) 耐酸性试验;(b) 耐胆盐试验
3.3. 动物体重变化与肾脏重量
正常小鼠体重随着时间而增加,然而经顺铂诱导之小鼠组别,其两周后体重明显下降,正对照–药物处理组则可以减缓体重下降。对比喂食乳酸菌的组别,除了乳酸菌GKM3外,其余组别的小鼠体中皆有下降缓和的情形(图3(a))。其中以喂食菌株GKLC1的效果最佳。肾脏重量方面,则以顺铂诱导组明显造成肾脏肿大,有重量增加的现象;而药物处理组与乳酸菌GKLC1组皆可以降低肾肿大的影响,维持与正常组相近的肾脏重量(图3(b))。
 (a)
(a)  (b)
(b)
Figure 3. (a) Weight changes and (b) Renal mass in cisplatin-induced ICR male mice. ***presented a significant difference when probiotics groups compared with the cisplatin group (p < 0.001); ###presented a significant difference when the cisplatin group compared with the normal control (p < 0.001)
图3. 顺铂诱导之ICR小鼠(a) 体重变化与(b) 肾脏重量。肾脏重量以平均值(mean) ± 标准偏差(SD)表示,以Student’s t-test进行统计差异分析。乳酸菌组与顺铂诱导组(cisplatin-induced group)相比具统计差异者,以***p < 0.001表示;顺铂诱导组与正常组(normal group)相比具统计差异者,以###p < 0.001表示
3.4. 血清中BUN与CRE含量
血清尿素氮(BUN)和肌酸酐(CRE)是评估肾脏健康的指标,是一般代谢会产生的物质,经过肾脏排除,故肾脏受损时,血清中BUN和CRE会升高。图4为小鼠切清中BUN和CRE含量分析。顺铂会造成肾
 (a)
(a)  (b)
(b)
Figure 4. Levels of (a) Blood urea nitrogen and (b) Creatinine in cisplatin-induced ICR male mice. Significant differences when probiotics groups compared with the cisplatin group were presented as *p < 0.05, **p < 0.01, and p < 0.001; ###presented a significant difference when the cisplatin group compared with the normal control (p < 0.001)
图4. 顺铂诱导之ICR小鼠(a) 血清尿素氮与(b) 肌酸酐含量。结果数值以平均值(mean) ± 标准偏差(SD)表示,以Student’s t-test进行统计差异分析。乳酸菌组与顺铂诱导组(cisplatin-induced group)相比具统计差异者,以*p < 0.05、**p < 0.01、***p < 0.001表示;顺铂诱导组与正常组(normal group)相比具统计差异者,以###p < 0.001表示
损伤,故血清中BUN含量明显提高,而药物处理组或乳酸菌GKLC1、GKLR1、GKLF3明显具减缓BUN的提升。血清中CRE含量的减缓,与顺铂组相比,则以GKLC1、GKLR1、GKLF3、以及GKM3皆有显著差异。
3.5. 肾组织病理分析
在顺铂诱导的组别,其肾组织的坏死程度明显,而药物组与乳酸菌组皆可以减缓肾组织的病变(图5(a))。以病理评分来看,顺铂皆可以造成严重的坏死与透明圆柱体(Hyaline cast)的出现。以坏死程度改善来说,药物处理组与乳酸菌GKLC1组相比顺铂诱导组最具显著性差异;其次是乳酸菌GKLF3、GKLR1、以及GKM3。Hyaline cast评分上,亦是药物处理组与乳酸菌GKLC1组相比顺铂诱导组最具显著性改善(图2(b))。而摄食GKLK2皆没有改善病理分数。
4. 讨论
本次试验分别自动、植物来源分离5株乳酸菌菌株(图1)。明显可以发现这5株菌株的特性差异甚大;其中菌株GKLK2和GKLR1在耐酸性和耐胆盐的效果差于其他菌株,而这两株菌株为自动物来源分离的(图2)。一般来说,动物来源的乳酸菌虽然在人体肠道的吸附力较佳,但对于环境的耐受性较差;相反的,植物来源的乳酸菌因生长环境较为严苛,被认为对于环境的耐受性较佳,可通过人体胃酸及胆盐环境,像是自植物来源的菌株GKLF3和GKM3确实有较佳的耐酸与耐胆盐效果 [22] [23]。值得注意的是,菌株GKLC1虽然分离自动物来源,却依然表现不错的耐酸与耐胆盐特性,是值得关注且具益生菌潜力的菌株。
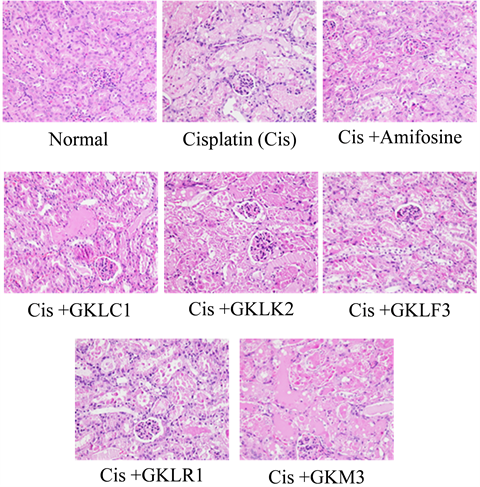 小鼠肾脏组织以苏木精-伊红染色(hematoxylin and eosin stain, H&E stain),于显微镜400×下观察组织病理结构。(a)
小鼠肾脏组织以苏木精-伊红染色(hematoxylin and eosin stain, H&E stain),于显微镜400×下观察组织病理结构。(a)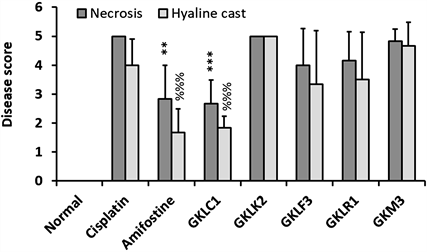 (b)
(b)
Figure 5. (a) Kidneys tissue sections of cisplatin-induced ICR male mice; (b) Disease score of the kidneys tissue in cisplatin-induced ICR male mice. Significant differences with cisplatin group in necrosis were presented as **p < 0.01 and ***p < 0.001; a significant difference with cisplatin group in hyaline cast was presented as %%%p < 0.001
图5. (a) 顺铂诱导之ICR小鼠肾脏组织切片;(b) 顺铂诱导之ICR小鼠肾脏组织病理评分。疾病分数依照组织病变面积,分别给予分数1 = 少许(<1%)、2 = 轻微(1%~25%)、3 = 中等(26%~50%)、4 = 中度严重(51%~75%)、以及5 = 严重(76%~100%)。结果数值以平均值(mean) ± 标准偏差(SD)表示,以Student’s t-test进行统计差异分析。各乳酸菌组之组织坏死(necrosis)总分与顺铂诱导组(cisplatin-induced group)相比具统计差异者,以**p < 0.01、***p < 0.001表示;分析项目为透明圆柱体(hyaline cast),则以%%%p < 0.001表示乳酸菌组与顺铂诱导组的显著差异
氨磷汀(amifostine)是一个含磷酸硫(thiophosphate)的细胞保护剂,可减少癌症化学治疗引起的毒性作用 [24]。故本试验以氨磷汀作为顺铂诱导AKI之动物模式正对照组。可发现经单一剂量之顺铂处理后一周,小鼠的肾脏体重明显增加;而先于注射氨磷汀的小鼠,其肾脏体重上升最趋缓(图3)。说明本试验顺铂成功地诱导肾损伤,以下菌株对于肾脏保护的效果方可讨论。
肾脏主要功能包含代谢物的排除、水分调节、电解质平衡、稳定血液酸碱值等 [25]。临床上,AKI的诊断方式有两种。一种是量测一天的尿量,若6小时内的尿量少于0.5 c.c./kg/hr,则可能有肾脏相关的问题。另一种检测是看血清肌酸酐(CRE)来判读,定义48小时内CRE值大于或等于0.3 mg/dL则判定为AKI [26]。在本次试验中,顺铂处理后一周的小鼠CRE明显比正常组高出许多,透过药物氨磷汀的预防处理可以缓和升高的CRE (图4)。与顺铂诱导组相比,菌株GKLC1最具显著降低CRE,说明菌株GKLC1可以预防药物引起的AKI,達腎臟保護的效果。呼应肾组织病变的改善结果,未来菌株GKLC1很有可能發展為腎臟保護的益生菌(图5)。
关于肠道菌与肾脏功能的研究是息息相关的 [27]。在肾病变的患者中,其肠道菌相(gut microbiota)与健康人是有显著差异的 [28]。当肠道菌群失调,坏菌产生大量尿毒素,例如硫酸吲哚酚(indoxyl sulfate)、硫酸对甲酚(p-cresyl sulfate)、三甲胺-N-氧化物(trimetlylamine oxide, TMAO)等,造成肠道屏障被破坏,从而让毒素进入血液,在全身循环,最后造成肾损伤 [29]。以TMAO为例,特定菌株之乳酸菌可以调节肠道菌平衡,抑制肠道中与产生TMA (TMAO前驱物)有关的菌,藉此减少肠道中或血液中的TMAO [30]。透过益生菌疗法来调节肠道、避免肾脏受损速度等,是一个有愿景的方法 [31]。而本次试验中,初步筛选到有肾脏保护潜力的鼠李糖杆菌GKLC1,后续需再进行GKLC1与肾保护的相关机制研究,才有利于应用上的实施。
5. 结论
本文研究自可食用动、植物素材中分离5株乳酸菌菌株,并做基本特性分析后,制备成菌粉。分别喂食小鼠两周,于第11天利用注射20 mg/kg b.w.的一剂顺铂诱发小鼠急性肾损伤,并观察注射4天后小鼠肾脏状况。鼠李糖杆菌GKLC1除了在基本特性上具良好的耐酸性与耐胆盐能力外,动物试验结果也具有减缓因顺铂造成的小鼠血清尿素氮与肌酸酐升高。故本次筛选结果,以鼠李糖杆菌GKLC1最具肾功能保护的潜力。
NOTES
*通讯作者。