修回日期: 2021-02-20
接受日期: 2021-03-26
在线出版日期: 2021-05-08
随着全球人口老龄化和非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)增长, 老年NAFLD人群特点的研究尤为重要.
观察老年NAFLD患者的营养状态和能量代谢特点.
回顾性分析2017-01/2019-01天津市第三中心医院消化科就诊的NAFLD老年患者118例, 进行人体成分分析仪分析及应用代谢车评估营养及能量代谢指标, 与老年非脂肪肝组进行比较. 统计分析中正态分布计量资料采用独立样本t检验, 非正态分布计量资料采用Mann-Whitney U检验, 二元Logistic回归分析老年NAFLD发生的危险因素.
人体成分分析显示老年NAFLD组腰臀脂肪比、体脂肪含量较老年非脂肪肝组明显增加(腰臀脂肪比0.95 vs 0.92, 体脂肪27.20 kg vs 19.60 kg, P<0.005); 代谢车测定结果显示老年NAFLD组静息能量消耗均高于老年非脂肪肝组(1769.00 kcal/d vs 1323.00 kcal/d, P<0.05); 进一步比较老年NAFLD患者轻度脂肪肝组与中重度脂肪肝组, 轻度脂肪肝组体脂肪、腰臀脂肪比、基础代谢、静息能量消耗明显低于中重度脂肪肝患者.
在老年NAFLD患者中存在营养失衡和能量代谢紊乱, 随脂肪肝程度加重更为显著, 通过人体成分分析仪和代谢车以综合评价和监测老年NAFLD患者的营养及能量代谢状态, 为疾病干预治疗提供依据.
核心提要: 随着全球人口老龄化和非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)增长, 老年NAFLD人群特点的研究尤为重要. 在老年NAFLD患者中存在营养失衡和能量代谢紊乱, 随脂肪肝程度加重更为显著, 通过人体成分分析仪和代谢车以综合评价和监测老年NAFLD患者的营养及能量代谢状态, 为疾病干预治疗提供依据.
引文著录: 刘芳, 叶青, 梁静, 曹影影, 史利利, 赵雪, 向慧玲. 老年非酒精性脂肪性肝病的营养状况及能量代谢特点. 世界华人消化杂志 2021; 29(9): 467-473
Revised: February 20, 2021
Accepted: March 26, 2021
Published online: May 8, 2021
With the aging of global population and the increase in the incidence of NAFLD, the research of elderly NAFLD population is particularly important.
To study the nutritional status and energy metabolism in elderly patients with nonalcoholic fatty liver disease (NAFLD) to provide evidence for disease evaluation, clinical monitoring, and treatment intervention.
One hundred and eighteen elderly patients (≥ 60 years) with NAFLD were enrolled at Department of Gastroenterology Tianjin Third Central Hospital from January 2017 to January 2019. A non-NAFLD group consisting of non-NAFLD volunteers ≥ 60 years was also included. Nutritional status and energy metabolism were evaluated with a body composition analyzer and metabolic cart ( anthropometric measurement, clinical biochemical examination, etc.).
Body composition analysis showed that the waist-to-hip fat ratio and body fat content of the NAFLD group were significantly higher (waist-to-hip fat ratio 0.95 vs 0.92, body fat 27.20 vs 19.60 kg, P < 0.05) compared with those of the non-NAFLD group. The results of metabolic vehicle showed that the resting energy expenditure (REE) of the NAFLD group was increased (1769.00 vs 1706.00 vs 1323.00). In elderly NAFLD patients, body fat, waist-to-hip fat ratio, basal metabolism, and REE in the mild fatty liver group were significantly lower than those in the moderate-severe fatty liver group.
In elderly patients with NAFLD, there are nutritional imbalance and energy metabolism disorder. The nutritional status and energy metabolism of elderly NAFLD patients can be comprehensively evaluated and monitored with a body composition analyzer and metabolic vehicle, so as to provide evidence for disease intervention.
- Citation: Liu F, Ye Q, Liang J, Cao YY, Shi LL, Zhao X, Xiang HL. Nutritional status and energy metabolism in elderly patients with nonalcoholic fatty liver disease. Shijie Huaren Xiaohua Zazhi 2021; 29(9): 467-473
- URL: https://www.wjgnet.com/1009-3079/full/v29/i9/467.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v29.i9.467
目前非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)已成为全球普遍关注的医学问题和社会问题[1], NAFLD以营养过剩和代谢紊乱为特点, 与代谢综合征密切相关[2,3], 其发生率逐年增加, 部分患者可进展成为肝纤维化、肝硬化甚至肝癌, 尽管心血管疾病是NAFLD患者死亡的主要原因, 而肝脏相关死亡率呈明显增加趋势[4-6], 在未来几十年中, NAFLD可能会成为晚期肝病的主要病因[7]. 随着人口老龄化的加速, 未来老年NAFLD患者数量将继续增加, 因此对老年NAFLD人群特点的研究至关重要. 在本研究中着重探讨老年NAFLD人群的体脂肪相关指标、骨骼肌含量和基础代谢、静息能量消耗的变化, 为老年NAFLD的疾病评估和临床监测、干预治疗提供依据.
以2017-01/2019-01天津市第三中心医院消化科就诊的B超符合脂肪肝的非酒精性脂肪性肝病(NAFLD)的老年患者为研究对象, 依腹部B超结果分为轻度脂肪肝组和中重度脂肪肝组.
纳入标准: (1)NAFLD入选对象诊断依据2018年中华医学会肝脏病学分会脂肪肝和酒精性肝病学组修订的《非酒精性脂肪性肝病诊疗指南》[8]的诊断标准; (2)年龄≥60岁; (3)临床资料完整.
排除标准: (1)长期饮酒史, 酒精量男>30 g/d ,女>20 g/d, 连续5年以上; (2)合并有病毒性肝炎、药物性肝损伤、自身免疫性肝病、遗传性肝病; 肝硬化; (3)合并恶性肿瘤、其他严重心、肺、肾等重要脏器疾病、感染性疾病、甲状腺疾病、贫血; (4)失访或数据不完整的患者.
将同时期进行门诊检查的≥60岁老年非脂肪肝组作为对照组, 符合上述排除标准.
本研究获得天津市第三中心医院伦理委员会审查通过. 所有纳入人员均签署知情同意书.
1.2.1 人体指标检测: 测量身高、体重、腰围(取通过腋中线肋弓最低点和髂前上嵴最高点的中点沿腰围一周的距离)、臀围(沿臀部最膨隆处测量的距离), 计算腰臀比及身体质量指数(body mass index, BMI).
1.2.2 临床生化学指标及无创肝脏脂肪含量检测: 取血前24 h内禁止服用降脂药物, 禁食高脂肪食物和酒类; 检测临床生化学指标, 如血糖(glucose, GLU)、糖化血红蛋白(hemoglobin A1c, HbA1c)、血脂分析、游离脂肪酸(free fat acid, FFA)、肝功能[包括丙氨酸基转移酶(alanine aminotransferase, ALT)]、肾功能[包括肌酐(creatnine, Cr)], 其中血脂分析包括甘油三酯(triglyceride, TG)、总胆固醇(total cholesterol, TC)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol, HDLC)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol, LDLC)、极低密度脂蛋白胆固醇(very low density lipoprotein cholesterol, VLDLC). 无创肝脏脂肪评估(受控衰减参数controlled attenuation parameter, CAP)采用瞬时弹性成像技术进行肝脏脂肪含量检测(设备型号为Fibrotouch-B).
1.2.3 人体成分分析测定: 采用韩国产BiosPace Inbody 720型人体成分分析仪(多频生物电阻抗法)测定细胞内水、细胞外水、身体细胞量、骨矿物量、骨骼肌、蛋白质、脂肪、腰臀脂肪比含量等情况.
1.2.4 代谢车的测定: 采用美国SensorMedics公司生产的Vmax229全自动肺功能诊断及代谢检测系统(简称代谢车)进行基础代谢测定, 经气体分析装置分析吸进及呼出气体中O2和CO2浓度, 计算出该时间段内的耗氧量(VO2)和产生的二氧化碳(VCO2), 输入24 h尿总氮值(UN), 根据Weir公式: [3.941(VO2)+1.11(VCO2)]×1.44-2.17(UN), 计算出实测的静息能量消耗(rest energy expenditure, REE, Kcal/day).
统计学处理 采用SPSS 22.0统计软件进行统计分析. 计数资料采用构成比或率(%)进行统计描述, 组间比较采用χ2检验; 正态分布的计量资料用(mean±SD)表示, 两组间比较采用独立样本t检验, 非正态分布的计量资料应用中位数M(P25-P75)表示, 两组间比较采用非参数秩和检验(Mann-Whitney U检验), 采用二元Logistic回归分析老年NAFLD发生的危险因素. 所有的统计分析均基于双侧假设检验, P<0.05具有统计学意义.
纳入118例老年NAFLD患者为研究对象, 其中男46例, 女72例, 年龄60-83岁, 平均71.35岁. 表1显示了研究人群的基本参数. 在老年NAFLD组及老年非脂肪肝组间性别均无统计学差异; 老年NAFLD组BMI及腰臀比、腰围、臀围均高于老年非脂肪肝组(P值均<0.05); 临床生化学指标及无创肝脏脂肪含量检测结果, 老年NAFLD组GLU、HbA1c、TG、VLDLC、CAP均高于老年非脂肪肝组(P<0.05).
| 老年NAFLD组(n = 118) | 老年非脂肪肝组(n = 40) | t/Z | P值 | |
| 年龄(年) | 71.00(65.00-76.00) | 68.00(64.50-71.00) | -0.397 | 0.691 |
| BMI(kg/m2) | 28.60(26.05-30.70) | 24.90(23.40-26.35) | -5.025 | 0 |
| 腰臀比 | 0.95(0.90-0.99) | 0.92(0.88-0.97) | -2.701 | 0.007 |
| 腰围(cm) | 95.98±10.42 | 85.00±3.60 | 5.3 | 0 |
| 臀围(cm) | 101.00(95.50-110.00) | 90.00(88.00-91.50) | -3.644 | 0 |
| GLU(mmol/L) | 7.79(5.83-10.26) | 5.21(5.04-5.80) | -1.95 | 0.049 |
| HbA1c | 8.30(7.45-10.90) | 7.40(7.30-7.80) | -2.248 | 0.025 |
| TG(mmol/L) | 1.73(1.34-2.69) | 1.07(1.05-1.56) | -2.213 | 0.027 |
| TC(mmol/L) | 4.84±1.08 | 4.53±1.00 | 1.334 | 0.184 |
| HDLC(mmol/L) | 0.91(0.83-1.09) | 0.77(0.66-0.92) | -0.045 | 0.964 |
| LDLC(mmol/L) | 2.71±1.25 | 2.02±0.60 | 0.366 | 0.715 |
| VLDLC(mmol/L) | 1.11(0.78-1.43) | 0.81(0.74-1.11) | -1.986 | 0.047 |
| FFA(μmol/L) | 527.80(430.35-663.80) | 547.20(505.10-551.65) | -0.616 | 0.538 |
| ALT(U/L) | 21.00(14.50-36.50) | 10.00(8.50-28.50) | -1.77 | 0.077 |
| Cr(μmol/L) | 65.00(51.00-80.50) | 56.00(56.00-58.50) | -0.998 | 0.318 |
| CAP(dB/m) | 283.80±35.75 | 249.33±5.69 | 4.018 | 0 |
表2中人体成分分析及代谢率指标结果显示, 老年NAFLD组细胞内水、细胞外水、身体细胞量、蛋白质、体脂肪、腰臀脂肪比、基础代谢、静息能量消耗均明显高于老年非脂肪肝组(P<0.05), 骨骼肌呈下降趋势(P = 0.058).
| 老年NAFLD组 | 老年非脂肪肝组 | t/Z | P值 | |
| 细胞内水 | 21.19±3.94 | 18.77±1.47 | 3.363 | 0.001 |
| 细胞外水 | 13.58±2.47 | 12.47±1.53 | 3.518 | 0.001 |
| 身体细胞量(kg) | 30.65±5.89 | 26.83±2.06 | 3.518 | 0.001 |
| 骨矿物量(kg) | 2.66±0.45 | 2.63±0.26 | 1.851 | 0.066 |
| 骨骼肌(kg) | 25.19±5.55 | 26.02±4.17 | 1.911 | 0.061 |
| 蛋白质(kg) | 9.25±1.78 | 8.10±0.62 | 3.501 | 0.001 |
| 体脂肪(kg) | 27.20(24.00-30.65) | 19.60(19.30-23.90) | -4.448 | 0.000 |
| 腰臀脂肪比 | 0.95±0.05 | 0.92±0.03 | 3.002 | 0.003 |
| 基础代谢(kcal/d) | 1395.41±191.29 | 1286.67±87.36 | 3.556 | 0.001 |
| 静息能量消耗(kcal/d) | 1769.00(1546.00-2098.50) | 1323.00(1255.00-1336.00) | -2.025 | 0.043 |
在研究的老年人群中, 应用二元Logistic回归分析结果显示, 在校正性别、年龄、 生化学指标等变量后, BMI、腰围、体脂肪、腰臀脂肪比是老年NAFLD发生的危险因素, 结果见表3.
| 老年NAFLD(是/否) | OR (95%CI) | P值 |
| BMI | 1.531 (1.031-2.274) | 0.035 |
| 腰围 | 1.129 (1.035-1.231) | 0.006 |
| 体脂肪 | 1.363 (1.151-1.614) | 0.000 |
| 腰臀脂肪比 | 1.172 (1.004-1.364) | 0.044 |
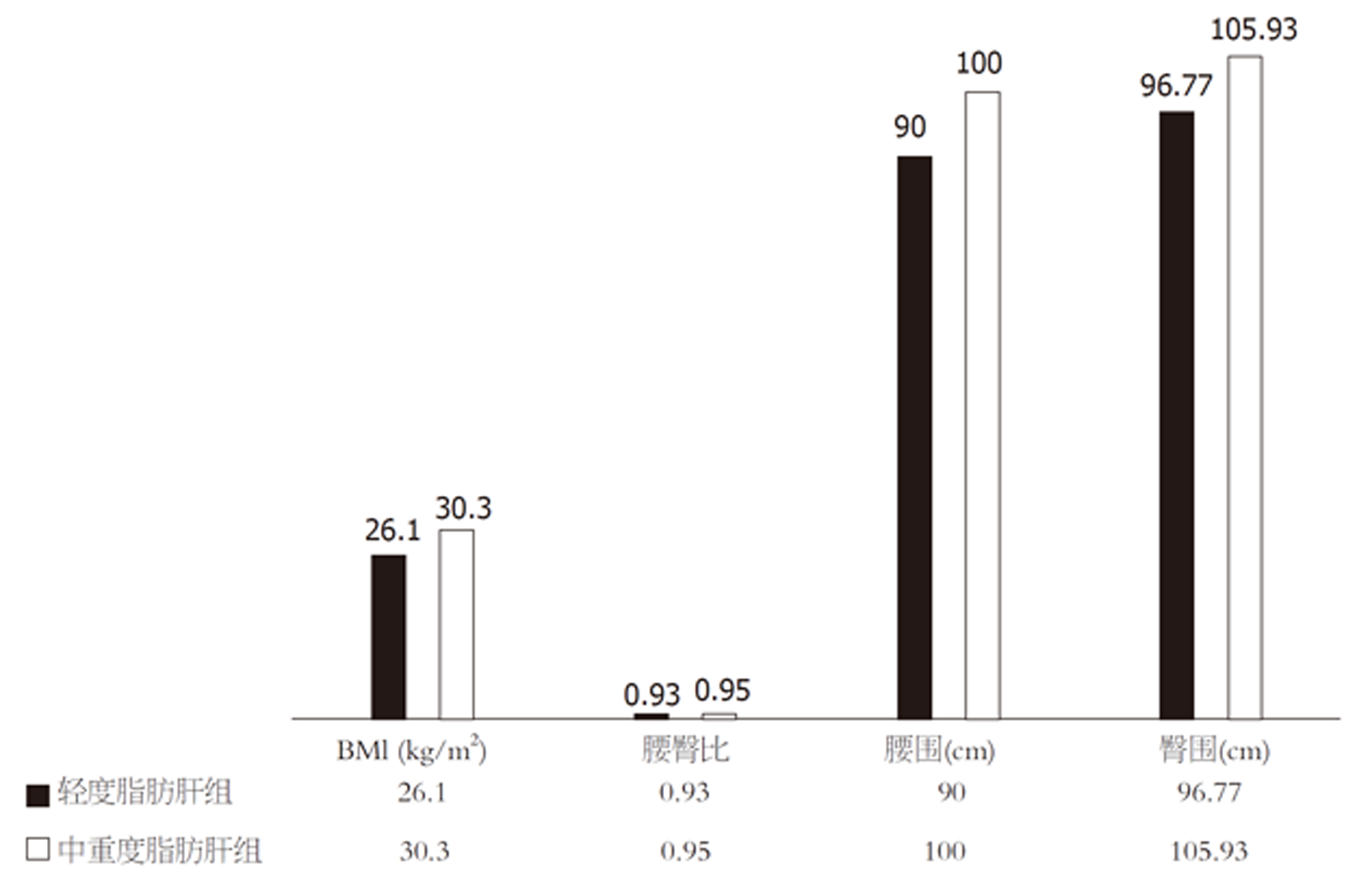
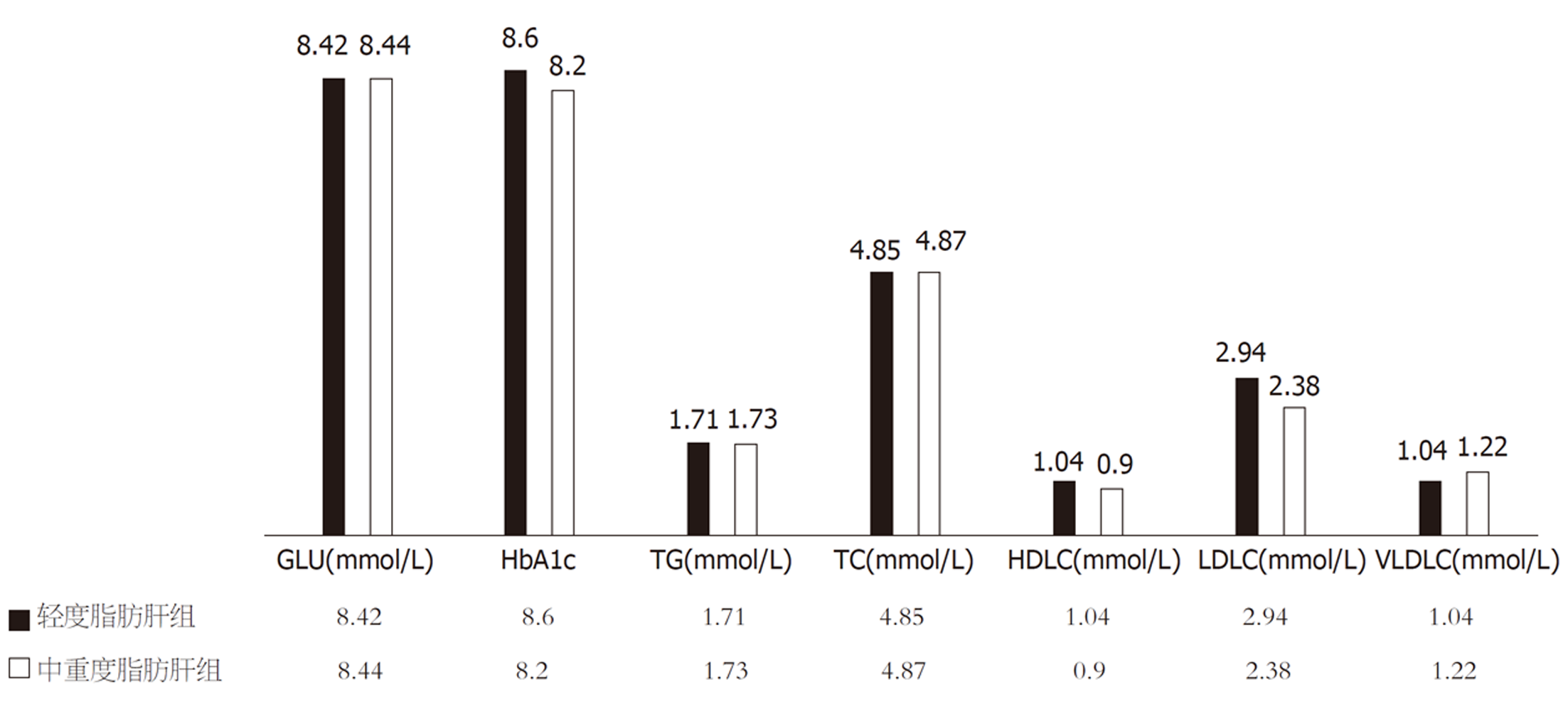
本研究老年NAFLD患者中, 在轻度脂肪肝组及中重度脂肪肝组的年龄及性别均无统计学差异(年龄70岁 vs 73岁, P = 0.055; 男性比例37.21% vs 40.00%, P = 0.765); 轻度脂肪肝组BMI、腰臀比、腰围、臀围低于中重度脂肪肝组(P值均<0.05), 结果见图1; 两组生化学指标比较见图2, 其中TG、VLDLC明显低于中重度脂肪肝组(P值分别为0.001和0.006), HDLC则高于中重度脂肪肝组(P = 0.031); 表4显示在人体成分分析的指标中, 轻度脂肪肝组细胞内水、细胞外水、身体细胞量、蛋白质、基础代谢、体脂肪、腰臀脂肪比、基础代谢、静息能量消耗与中重度脂肪肝组比较, 则明显降低(P<0.05), 中重度老年脂肪肝组骨骼肌含量呈下降趋势 (P = 0.068).
| 老年脂肪肝 | 老年脂肪肝 | t/Z | P值 | |
| 轻度脂肪肝组(n = 47) | 中重度脂肪肝组(n = 71) | |||
| 细胞内水 | 19.29±3.06 | 22.74±3.95 | -3.604 | 0 |
| 细胞外水 | 12.36±1.74 | 14.58±2.55 | -3.396 | 0.001 |
| 身体细胞量(kg) | 27.63±4.38 | 33.11±5.87 | -3.899 | 0 |
| 骨骼肌(kg) | 25.91±6.24 | 25.03±5.11 | 1.852 | 0.068 |
| 蛋白质(kg) | 8.33±1.32 | 9.99±1.78 | -3.824 | 0 |
| 体脂肪(kg) | 24.85(19.88-27.05) | 28.70(26.20-33.80) | -5.191 | 0 |
| 腰臀脂肪比 | 0.92±0.05 | 0.97±0.04 | -5.277 | 0 |
| 基础代谢(kcal/d) | 1299.27±140.81 | 1473.74±193.25 | -3.797 | 0 |
| 静息能量消耗(kcal/d) | 1686.50(1504.50-1828.50) | 1802.00(1663.00-2155.00) | -2.531 | 0.011 |
中国老龄化的挑战日益突显, 其中NAFLD问题更为普遍, NAFLD是遗传易感、环境因素和宿主代谢紊乱相互作用导致的复杂疾病, NAFLD发生与代谢综合征互为因果[9], 尽管NAFLD患者中存在非肥胖型NAFLD[10], 但是肥胖仍然是NAFLD发生的重要因素, 与NAFLD患病率及其严重程度密切相关. 在我们的研究老年NAFLD组肥胖型(BMI≥25 kg/m2)[11]比例达90%, 提示肥胖型NAFLD为主导, 老年NAFLD患者BMI、腰围、臀围、腰臀比明显升高, 且与老年脂肪肝的严重程度相关, 多因素二元Logistic回归分析结果显示随BMI、腰围增加发生NAFLD的风险明显增加, 较臀围、腰臀比更能反映老年NAFLD发病风险.
BMI作为评估和诊断肥胖程度的关键指标, 但在人体肌肉及脂肪组织的成分分析却存在一定局限性, 而人体成分分析能够测量肌肉、蛋白、脂肪和细胞内外水分等不同成分的含量, 目前认为生物电阻抗法(bio-electrical impedance analysis, BIA)人体成分分析技术是一个可靠、简便、安全的营养状态及体型判断的无创评估手段[12]. 在我们的研究中, 老年NAFLD患者脂肪组织明显增加, 同时细胞内水、细胞外水、身体细胞量也增加, 其中体脂肪及腰臀脂肪比是老年NAFLD的独立危险因素, 与老年NAFLD发生密切相关, 老年脂肪肝患者体脂分布异常, 随着体脂肪、腰臀脂肪比的增加, 脂肪肝程度明显加重. 先前有研究显示随BMI增加则机体具有更多的细胞(如脂肪细胞等), Balakrishnan等[13]针对48例NAFLD患者的研究也提出人体脂肪量与NAFLD发生风险显著相关, 每增加5 kg, NAFLD风险明显增加(OR: 1.27, 95%CI: 1.04-1.54), 我们的结果与这些研究一致.
衰老导致身体成分发生变化, 特别是肌肉含量的减少, 成为机体能量消耗随着年龄的增加而降低的重要因素[14]. 静息能量消耗(rest energy expenditure, REE)占人体总能量消耗的60%-70%, 略高于在更严格条件下测得的基础代谢率. 通过测量REE可以间接反映机体的能量需求, 以维持机体正常功能和人体觉醒状态, 目前这种间接量热法已经取代直接量热法成为临床工作中最常用的测定人体能量消耗的一种方法[15]. 一项纳入301例NAFLD患者的研究[16]认为NAFLD患者的代谢消耗明显升高, 与对照组相比, NAFLD患者REE更高(1523 kcal vs 1464 kcal, P = 0.005),而且较高的脂肪变性水平与较高的代谢消耗显著相关. 我们针对老年NAFLD人群的研究也得出相同结论, 老年NAFLD患者REE明显升高, 在中重度脂肪肝患者尤为突出, 即老年NAFLD严重程度越高, 其REE值越高, 可能与体重增加、肥胖有关, 由于肥胖人群机体组织结构失衡和代谢紊乱[17], 具有更高的能量需求, 因此BMI不同则REE并不相同, 有研究提出REE在评估和管理肥胖相关的心脑血管疾病、糖尿病、代谢综合征等起着核心作用[18]. 有研究提出[16], 具有高REE患者体重下降更快, 消耗的蛋白质可能比碳水化合物多, 因此, NAFLD患者的治疗干预可以参考其人体成分分析的改变进行更精准研究, 为患者制定个体化方案.
本研究仍然存在一定的不足, 该研究为观察性研究, 且为单中心数据, 为减少可能存在的偏倚, 在今后的研究中, 尚需进一步开展多中心、大样本和前瞻性研究, 为老年NAFLD营养和代谢的临床特点提供数据支持.
总之, 本研究探讨老年NAFLD患者人体结构方面改变, BMI、腰围、臀围、腰臀比增加, 体脂肪、腰臀脂肪比升高, 伴静息能量消耗增加, 同时合并血糖升高、血脂异常, 表现出明显的营养失衡和能量代谢紊乱, 在临床工作中可以综合人体成分分析来评估老年NAFLD患者的营养及能量代谢状态, 特别是超重、肥胖患者的身体评估至关重要, 及时发现潜在风险, 综合管理, 对预防和延缓老年NAFLD进展提供新的预警策略.
由于非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)可能会成为晚期肝病的主要病因. 人口老龄化导致老年NAFLD患者数量增加, 因此对老年NAFLD人群特点的研究至关重要.
运用人体成分分析仪及代谢车分析老年NAFLD的营养及能量代谢特点,以期为评估疾病状况及治疗提供参考.
本篇论文研究的主要目标是探讨人体成分分析仪及代谢车的应用在老年NAFLD营养及能量代谢状况的评估作用. 结果显示老年NAFLD的营养状况和能量代谢特点, 为临床提供一种全新评估方法.
本篇论文为了达到目标, 运用人体成分分析仪及代谢车对老年NAFLD及严重程度进行回顾性数据分析.
本篇论文研究达到了实验目标, 研究结果显示老年NAFLD的腰臀脂肪比、体脂肪含量明显增加(P<0.005), 静息能量消耗均高于老年非脂肪肝组(P<0.05); 而且老年NAFLD随脂肪肝程度加重, 体脂肪、腰臀脂肪比、基础代谢、静息能量消耗的升高更为显著. 本研究结果说明应用人体成分分析仪及代谢车, 有助于临床上更全面准确的对老年NAFLD的疾病状况进行评估.
老年NAFLD患者人体结构方面改变, 特别是体脂肪、腰臀脂肪比升高, 伴静息能量消耗增加, 表现出明显的营养失衡和能量代谢紊乱, 通过人体成分分析及及代谢车可以综合评估老年NAFLD患者的营养及能量代谢状态, 特别是超重、肥胖患者的身体评估至关重要, 对预防和延缓老年NAFLD进展提供新的预警策略.
该研究为回顾性观察研究, 且为单中心数据, 未来研究的方向, 为减少可能存在的偏倚, 尚需进一步开展多中心、大样本和前瞻性研究.
学科分类: 胃肠病学和肝病学
手稿来源地: 天津市
同行评议报告学术质量分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): 0
E级 (差): E
科学编辑:张砚梁 制作编辑:张砚梁
| 1. | Kim SK, Kim KI, Kim SR. Overview of Nonalcoholic Fatty Liver Disease/Nonalcoholic Steatohepatitis Management. Yakugaku Zasshi. 2019;139:1147-1153. [PubMed] [DOI] |
| 2. | Sheka AC, Adeyi O, Thompson J, Hameed B, Crawford PA, Ikramuddin S. Nonalcoholic Steatohepatitis: A Review. JAMA. 2020;323:1175-1183. [PubMed] [DOI] |
| 3. | Polyzos SA, Kountouras J, Mantzoros CS. Obesity and nonalcoholic fatty liver disease: From pathophysiology to therapeutics. Metabolism. 2019;92:82-97. [PubMed] [DOI] |
| 4. | Wang XJ, Malhi H. Nonalcoholic Fatty Liver Disease. Ann Intern Med. 2018;169:ITC65-ITC80. [PubMed] [DOI] |
| 5. | Dhanasekaran R, Felsher DW. A Tale of Two Complications of Obesity: NASH and Hepatocellular Carcinoma. Hepatology. 2019;70:1056-1058. [PubMed] [DOI] |
| 6. | Ge X, Zheng L, Wang M, Du Y, Jiang J. Prevalence trends in non-alcoholic fatty liver disease at the global, regional and national levels, 1990-2017: a population-based observational study. BMJ Open. 2020;10:e036663. [PubMed] [DOI] |
| 7. | Younossi Z, Anstee QM, Marietti M, Hardy T, Henry L, Eslam M, George J, Bugianesi E. Global burden of NAFLD and NASH: trends, predictions, risk factors and prevention. Nat Rev Gastroenterol Hepatol. 2018;15:11-20. [PubMed] [DOI] |
| 9. | Kim D, Touros A, Kim WR. Nonalcoholic Fatty Liver Disease and Metabolic Syndrome. Clin Liver Dis. 2018;22:133-140. [PubMed] [DOI] |
| 10. | Ye Q, Zou B, Yeo YH, Li J, Huang DQ, Wu Y, Yang H, Liu C, Kam LY, Tan XXE, Chien N, Trinh S, Henry L, Stave CD, Hosaka T, Cheung RC, Nguyen MH. Global prevalence, incidence, and outcomes of non-obese or lean non-alcoholic fatty liver disease: a systematic review and meta-analysis. Lancet Gastroenterol Hepatol. 2020;5:739-752. [PubMed] [DOI] |
| 11. | Papatheodoridi M, Cholongitas E. Diagnosis of Non-alcoholic Fatty Liver Disease (NAFLD): Current Concepts. Curr Pharm Des. 2018;24:4574-4586. [PubMed] [DOI] |
| 12. | Kivimäki M, Kuosma E, Ferrie JE, Luukkonen R, Nyberg ST, Alfredsson L, Batty GD, Brunner EJ, Fransson E, Goldberg M, Knutsson A, Koskenvuo M, Nordin M, Oksanen T, Pentti J, Rugulies R, Shipley MJ, Singh-Manoux A, Steptoe A, Suominen SB, Theorell T, Vahtera J, Virtanen M, Westerholm P, Westerlund H, Zins M, Hamer M, Bell JA, Tabak AG, Jokela M. Overweight, obesity, and risk of cardiometabolic multimorbidity: pooled analysis of individual-level data for 120 813 adults from 16 cohort studies from the USA and Europe. Lancet Public Health. 2017;2:e277-e285. [PubMed] [DOI] |
| 13. | Balakrishnan M, El-Serag HB, Nguyen T, Hilal J, Kanwal F, Thrift AP. Obesity and Risk of Nonalcoholic Fatty Liver Disease: A Comparison of Bioelectrical Impedance Analysis and Conventionally-Derived Anthropometric Measures. Clin Gastroenterol Hepatol. 2017;15:1965-1967. [PubMed] [DOI] |
| 14. | Kitazoe Y, Kishino H, Tanisawa K, Udaka K, Tanaka M. Renormalized basal metabolic rate describes the human aging process and longevity. Aging Cell. 2019;18:e12968. [PubMed] [DOI] |
| 15. | Pisanu S, Deledda A, Loviselli A, Huybrechts I, Velluzzi F. Validity of Accelerometers for the Evaluation of Energy Expenditure in Obese and Overweight Individuals: A Systematic Review. J Nutr Metab. 2020;2020:2327017. [PubMed] [DOI] |
| 16. | Reddavide R, Cisternino AM, Inguaggiato R, Rotolo O, Zinzi I, Veronese N, Guerra V, Fucilli F, Di Giovanni G, Leandro G, Giannico S, Caruso MG. Non-Alcoholic Fatty Liver Disease is Associated with Higher Metabolic Expenditure in Overweight and Obese Subjects: A Case-Control Study. Nutrients. 2019;11. [PubMed] [DOI] |
| 17. | Smith RL, Soeters MR, Wüst RCI, Houtkooper RH. Metabolic Flexibility as an Adaptation to Energy Resources and Requirements in Health and Disease. Endocr Rev. 2018;39:489-517. [PubMed] [DOI] |