修回日期: 2018-06-13
接受日期: 2018-07-15
在线出版日期: 2018-08-28
众所周知, 非酒精性脂肪肝病(non-alcoholic fatty liver disease, NAFLD)作为一个慢性代谢性疾病, 其发病机制复杂, 涉及到诸多因素. 其中肠道微生物失衡所导致的机体代谢紊乱是NAFLD发生发展的一个重要诱因. 相关研究发现肠道菌群的失调可引起肠道屏障的破坏, 进而导致相关有毒代谢产物入血和细菌移位的发生, 诱发肝脏炎症反应和损伤. 在此过程中, 肠肝之间的"对话"体现了肠-肝轴在NAFLD/NASH发病过程中的重要地位. 因此, 本文将就肠-肝轴参与NAFLD的发病机制及相关潜在的治疗策略进行一个简要的评述.
核心提要: 肠-肝轴作为引起非酒精性脂肪肝病(non-alcoholic fatty liver disease, NAFLD)发生发展的重要因素, 越来越引起人们的关注. 本文将就肠-肝轴参与NAFLD的发病机制及相关潜在的治疗策略进行一个简要的评述.
引文著录: 夏凡, 周本杰. 肠-肝轴功能紊乱在非酒精性脂肪肝病发病机制中的作用及相关治疗策略. 世界华人消化杂志 2018; 26(24): 1439-1447
Revised: June 13, 2018
Accepted: July 15, 2018
Published online: August 28, 2018
Non-alcoholic fatty liver disease (NAFLD) is a chronic metabolic disease whose pathogenesis is not fully understood and involves multiple factors. Metabolic disorder caused by gut microbial imbalance is a key factor contributing to the development of NAFLD. Several studies show that gut barrier dysfunction will cause the occurrence of toxic metabolites in blood and bacterial translocation. The "dialogue" between the gut and the liver highlights the key role of the gut-liver axis in the process of NAFLD. This paper will summarize the relationship between the gut-liver axis and the pathogenesis of NAFLD, as well as its implications for the treatment of NAFLD.
- Citation: Xia F, Zhou BJ. Role of gut-liver axis dysfunction in pathogenesis of non-alcoholic fatty liver disease: Implications for treatment strategies. Shijie Huaren Xiaohua Zazhi 2018; 26(24): 1439-1447
- URL: https://www.wjgnet.com/1009-3079/full/v26/i24/1439.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v26.i24.1439
非酒精性脂肪肝病(non-alcoholic fatty liver disease, NAFLD)是指除外酒精、肝炎病毒、药物等其他明确的损肝因素所致的, 以弥漫性肝细胞大泡性脂肪变性为主要特征, 伴或不伴炎症为主要病理特征的遗传-环境-代谢应激相关性临床病理综合征, 根据其病理演变过程可划分为单纯性脂肪肝(non-alcoholic simple fatty liver, NAFL)以及由其演变的非酒精性脂肪肝炎(non-alcoholic steatohepatitis, NASH)和肝纤维化甚至肝癌[1,2]. 近几十年来, 生活方式和饮食习惯的改变使NAFLD发病率逐年升高[3-5]. 最新的流行病学数据显示: NAFLD在世界范围内的患病率约为25.24%, 其中南美洲和中东地区最高, 非洲最低. 而在我国, NAFLD的患病率约为15.0%. 目前针对NAFLD的治疗主要为患者自身的生活规律及饮食的调整, 但考虑到患者自身的依从性, 加之NAFLD作为一个慢性代谢综合症在肝脏的表现, 其发病机制复杂, 且尚无理想的治疗药物和方法, 迫切需要寻找和挖掘新的治疗策略和靶点[6-10].
NAFLD公认的危险因素包括肥胖、脂质代谢异常、2型糖尿病等[8]. 目前占主流的多重打击学说指出营养过剩、胰岛素抵抗(insulin resistance, IR)、炎症, 氧化应激、肠道屏障损伤、内质网应激、遗传和表观遗传调控等作为多个平行相关的二次打击因素都参与了NAFLD的发生和发展过程[9,10]. 近年来, 肠道屏障损伤作为其中的一个重要因素, 日益受到研究者们的广泛关注. 因此, 本文将从肠-肝轴、肠道菌群及代谢产物、肠屏障通透性等方面来阐述肠-肝轴功能紊乱参与NAFLD的相关发病机制及相关治疗策略.
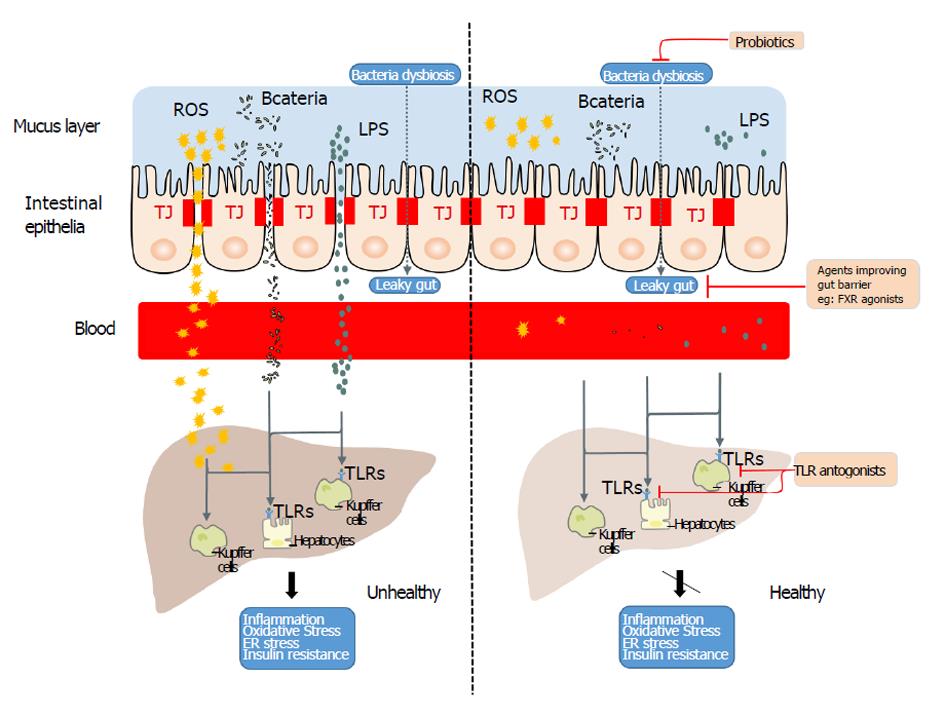
过去一直认为肠道的主要功能被认为是消化和吸收营养物质, 肝脏的主要功能被认为是物质代谢和解毒[11]. 相关的基础研究和临床资料均提示肠道和肝脏不是两个独立的器官, 二者在生物学功能上密切相关、相互影响[12,13]. 肠道除了消化吸收营养物质外, 还具备一定机体免疫功能. 肝脏是机体最大的实质性器官, 也是重要的免疫器官, 由占2/3的肝实质细胞、库弗氏细胞(Kupffer cells)、内皮细胞及胆管上皮细胞组成[14]. 此外, 二者有着相同的胚胎起源, 即前肠. 另一方面, 肠黏膜淋巴细胞可穿过肠道屏障到达肝脏, 游离于两个脏器之间, 防御病原体; 反过来, 肝脏自身对肠道来源的淋巴细胞具有一定的调节功能[15,16]. 因此, 肠道屏障作为机体的第一道防线保护机体免受肠腔内大量细菌、食物抗原、毒素等造成的损伤, 肝脏作为机体的第二道防线[17], 进一步参与和调节肠道屏障的免疫功能, 二者共同构筑起机体的防御系统, 即肠-肝轴. 现阶段的研究也发现NAFLD/NASH患者都有不同程度的肠道屏障功能障碍, 即内外因素导致的肠道屏障损伤会引起肠腔内细菌过度繁殖, 肠道微生态遭受破坏并产生大量的有毒代谢产物和内毒素. 进入血循环中的内毒素不仅直接损伤肠黏膜上皮细胞, 引起肠微血管收缩及肠道组织缺血缺氧, 导致大量ROS的产生, 加剧肠道屏障的损伤, 还会作用于肝脏, 造成肝脏的进一步损伤, 形成恶性循环[18-20]. 而在此过程中, 肠道屏障损伤所导致的肠道细菌及内毒素渗漏即为NAFLD发病机制中的二次打击因素, 揭示了肠道菌群/肠道通透性增加-代谢内毒素血症-炎症因子、氧化应激-肝脂肪变性/损伤为主要环节的肠-肝对话途径, 体现了肠-肝轴在NAFLD/NASH发病过程中的地位(图1).
肠道屏障受损后导致的肠道细菌、内毒素及相关代谢产物才是导致NAFLD的主要病原. 而人体肠道内共生的细菌达1-2 kg, 其细胞数目约为人体真核细胞的10倍左右, 如此庞大的细菌群落被当作是人体后天获得的"器官", 影响着宿主的消化、营养、代谢、免疫等方面[21,22]. 按生物学分类水平, 肠道菌群主要由厚壁菌门、拟杆菌门、放线菌、变形菌门、疣微菌门和少量的古生菌组成, 研究证实肠道菌群携带了大量与糖类、氨基酸代谢、生物素代谢以及次生代谢产物生成的基因, 参与了单纯性脂肪肝、非酒精性脂肪性肝炎等各个病理阶段, 其机制主要有诱发肠源性内毒素血症、内源性乙醇的产生、短链脂肪酸的调节功能、胆汁酸代谢等[23,24].
目前很多研究已明确肠源性内毒素血症与NAFLD的发生发展密切相关, 但相关机制一直未明确. 直到"代谢性内毒素血症"假说的提出, 二者之间的联系才得以很好地诠释[25]. 内毒素的核心成分脂多糖(lipopolysaccharide, LPS)作为革兰氏阴性菌细胞壁的主要成分在这一过程中扮演了主要的作用. 相关研究证明肥胖或NAFLD患者与正常人相比存在小肠细菌过度生长(enteric bacterial overgrowth syndrome, EBOS), 进而导致含有LPS成分的细菌数量增多[26]. LPS增多后能激活肠黏膜上腺苷酸环化酶, 损伤上皮细胞线粒体和溶酶体, 导致肠绒毛顶部细胞坏死和上皮细胞自溶, 使得局部肠黏膜破损, 肠道屏障受损, 通透性增加. 内毒素入血并随着肠肝循环进入肝脏, 并被肝脏Kupffer细胞或肝实质细胞中Toll样受体4(Toll-like receptor 4, TLR4)识别结合, 进而释放大量的细胞因子, 发生免疫炎症反应, 介导肝脏炎症和病理损害. 因此, LPS不仅引起炎症反应, 还可引起机体发生严重的代谢变化, 如促进脂肪消耗, 血清游离脂肪酸(free-fatty acid, FFA)、甘油三脂(triglyceride, TG)升高等, 其中FFA随着体循环沉积于肝脏可诱发炎症、胰岛素抵抗(insulin resistance, IR)、内质网应激(endoplasmic reticulum stress, ER stress)等, 进一步促进了NAFLD的发生和发展[27].
肠道微生物的数量和类别保持动态恒定是维持肠道内环境稳定的基础. 短链脂肪酸(short-chain fatty acids, SCFAs)作为肠道微生物菌群发酵的主要代谢产物, 其中乙酸、丙酸、丁酸约占SCFAs总量的90%-95%[28]. SCFAs除了作为供能物质以外, 还能参与机体炎症反应的调节. 已有研究证实无菌疾病小鼠出现机体炎症反应加重现象, 这可能与SCFAs的缺乏密切相关[29]. 单独改变肠道菌群结构进而导致SCFAs的变化可诱使肥胖的发生, 增加NAFLD患病率. 现已知SCFAs可直接影响组蛋白脱乙酰基酶(histone deacetylases, HDACs)来发挥相关的信号分子调节作用, 也可通过与GPCRs受体(G protein-coupled receptors, GPCRs)结合, 间接地影响HDACs发挥相关作用. 目前发现的GPCR受体有短链脂肪酸受体41/43(G protein-coupled receptor 41/43, GPR41/43)和烟酸受体(G protein-coupled receptor 109A, GPR109A)[30-32]. 其中GPR41和GPR43主要在脂肪细胞和肠内具有分泌功能的细胞中高度表达, 而GPR109A主要在脂肪细胞、肝细胞、结肠细胞中表达. 研究发现GPR41、GPR43在代谢、炎症和疾病调控中起到了重要的作用, 可能是治疗某些代谢性疾病的潜在药物靶点. 如: SCFAs与相关受体结合后, 能促进肠上皮细胞K+外流, 介导NLRP3炎症小体的激活, 从而维护肠道生态的平衡[33]; GPR41-/-小鼠结肠炎的易感性与核转录因子(nucleus factor-κB, NF-κB)的激活密切相关, 而SCFAs可通过抑制NF-κB活性, 降低促炎症细胞因子的释放达到抗炎的作用[34,35]; SCFAs与GPCR109A或GPCR43结合可诱导调节性T细胞 (regulatory T cell, Treg cell)和分泌IL-10的T细胞的分化, 进而抑制结肠炎的发生, 从而减轻微生物细胞成分和其他代谢产物对肝脏的损伤, 延缓NAFLD的病理进展[36]. SCFAs与GPR43等受体结合还可刺激脂肪细胞中瘦素合成的增加, 降低组织胰岛素敏感性, 减少脂肪蓄积, 间接影响肝脏胰岛素的敏感性, 发挥NAFLD的治疗作用[37]. SCFAs还能通过激活腺苷酸活化蛋白激酶(adenosine monophosphate-activated protein kinase, AMPK)信号通路, 参与脂质及能量代谢、胰岛素敏感性、氧化应激等方面的调节, 直接抑制NAFLD的病情发展[38]. 因此, 肠道特定微生物菌群内代谢产物SCFAs及其受体可能通过多种途径 (肠道、脂肪组织、肝脏)直接或间接影响肥胖相关NAFLD的发生发展, 并已成为NAFLD研究的热点之一.
Zhu采用16SrRNA测序的方法定量检测了合并NASH和不合并NASH的肥胖患者与健康儿童肠道菌群的结构差异情况[39]. 发现二者存在明显的差异性, 如大肠埃希菌在合并NASH患者肠道内的数目比例比不合并NASH肥胖患者的数目比例要大[40]. 另有研究发现大肠埃希菌可刺激机体产生更多的内源性乙醇. 内源性乙醇在机体内可代谢为乙醛. 代谢产生的乙醛一方面影响肠上皮细胞紧密连接结构, 造成肠道屏障通透性增加, 肠源性乙醇/乙醛随血流进入肝脏, 继而诱发肝细胞脂肪变性, 进而发展成为与酒精性脂肪肝病(alcohol fatty liver disease, ALD)症状类似的NAFLD[41,42]. 这也间接地说明了NAFLD与ALD二者在诸多病理表现上相似的原因.
胆汁酸(bile acid, BA)与法尼酯衍生物X受体(farnesoid X receptor, FXR)以及G蛋白偶联的胆汁酸受体5(G protein coupled bile acid receptor 5, TGR5)在机体的糖、脂质、能量平衡以及炎症反应方面扮演着重要的作用. 胆汁酸的分泌以及相关信号通路的调节与NAFLD的发生发展密切相关. 胆汁酸受体在机体内有很高的组织特异性: (1)肠道组织中的FXR激活能调节固醇调节原件结合蛋白(sterol regulatory element-binding protein-1, SREBP-1)的表达, 进而对脂质代谢产生积极的调节作用; (2)分布于肝组织中的FXR激活后, 可增加胰岛素敏感性、减轻肥胖及炎症因子的释放; (3)胆汁酸与TGR5结合引起胰高血糖素样肽1(glucagonlike peptide-1, GLP1)和肽YY(peptide YY, PYY)的分泌, 参与机体血糖水平的调节[43]; (4)胆汁酸能影响肠道菌群的组成. 反过来, 肠道菌群自身分泌产出的一些酶也能对胆汁酸产生一定的化学修饰作用, 具体表现为: 胆汁酸能破坏细菌细胞膜进而对其内部结构造成破坏, 产生抑菌作用[44]. 而肠道菌群中一些菌种如: 乳酸菌、双歧杆菌产生的胆盐水解酶能将胆盐水解成非结合的胆酸(unconjugated cholic acid, CA)及鹅去氧胆酸(chenodeoxycholic acids, CDCA). 非结合的胆酸和鹅去氧胆酸又可进一步被肠道梭菌代谢成为脱氧胆酸(deoxycholic acid, DCA)和石胆酸(lithocolic acid, LCA). CA, CDCA, DCA , LCA对脂质的溶解和吸收作用减弱, 进而影响了血浆LDL-C的水平, 参与脂质代谢的调节[45]. 越来越多的文献报道, 肝脏内FXR的激活能缓解肝脏细胞的脂肪变性, 而关于肠道内FXR在NAFLD发生发展中所扮演的角色, 目前存在比较大的争议, 其中FXR与激动剂结合能介导成纤维细胞生长因子15(fibroblast growth factor 15, FGF15)信号通路减少小鼠体重以及脂肪变性, 相反的, FXR与拮抗剂结合能通过作用于SREBP-1减少肝脏的脂肪变性, 延缓NAFLD的发展[46,47]. 因此, 关于肠道内FXR在NAFLD中所发挥的作用还有待进一步研究和确定.
NAFLD作为一个多系统疾病, 其发病机制与肠道屏障通透性相关. 肠道菌群及其相关代谢产物可直接透过肠道屏障, 进入血循环到达肝脏, 引起肝脏的免疫-炎症反应, 促进和加剧NAFLD的发展. 生物结构上, 肠道屏障主要是肠上皮细胞通过紧密连接(tight junctions, TJ)构成, 肠黏液覆盖于肠上皮细胞表面, 潘氏细胞分泌不同的抗菌肽, 组成抗菌系统分布于内腔中, 抑制肠道菌群的过度生长. 从解剖学上, 肝脏和肠道门静脉系统密切地联结在一起, 肝脏接受门静脉回流的肠道血液, 同时随着门静脉回流入肝脏的肠道血液中的食物抗原、肠道细菌及产物、毒素等会激活肝脏的固有免疫系统, 发挥清除有害物质的作用; 反过来肝脏可通过胆汁分泌, 以肝肠循环的方式作用于肠道; 而按功能划分肠道屏障可分为机械屏障、化学屏障、免疫屏障等[48].
相关研究结果显示肠道黏膜机械屏障的损伤与NAFLD的发生发展密切相关. 正常情况下, 完整的肠上皮细胞间紧密连接可阻止肠道细菌及内毒素等大分子物质通过, 从而防止其发生移位. 当肠道上皮细胞间的紧密连接完整性受损时, 肠道黏膜的通透性增高, 肠道内的内毒素随着门静脉系统大量涌入肝脏, 除了对肝脏的直接毒性作用, 还可激发Kupffer细胞释放大量的炎症因子, 促进NAFLD的发展[49].
肠道化学屏障主要包括胆汁、各种消化酶、胃酸等. 胆汁酸作为一种信号转导分子激活相应膜受体和核受体来调节糖脂代谢平衡, 参与抑制小肠细菌过度生长和细菌移位, 保护肠道黏膜和屏障功能的完整性及肠内环境的稳定[50]. 如, 胆汁酸与TGR5或FXR受体结合能引起相关基因表达的变化, 如乙酰辅酶A羧化酶1(acetyl-coA carboxylase 1, ACACA)、脂肪酸合成酶(fatty acid synthetase, FAS)、葡萄糖-6-磷酸脱氢酶(glucose 6-phosphatedehydrogenase, G-6-PD)等的表达, 参与肝脏糖及脂质代谢的调节[51]. 另有研究表明敲除FXR基因的小鼠不但表现胆汁酸、甘油三酯、胆固醇水平显著升高, 肝内脂质蓄积, 还存在胰岛素抵抗的现象[52]. 因此肠道化学屏障在NAFLD的发生发展中扮演了重要的作用.
肠道免疫屏障主要由浆细胞分泌的免疫球蛋白A(secretory immunoglobulin A, SIgA)与肠黏膜内的淋巴组织构成. IgA(immunoglobulin A)对肠道细菌有很强的亲和抑菌能力. 当肠道黏膜受损时, 会导致IgA分泌减少, 进而促进了肠内细菌的移位, 导致细菌的脂肽、脂多糖、鞭毛蛋白等抗原被TLR受体识别结合, 引起免疫-炎症级联反应, 加剧肠道屏障的损伤, 促进NAFLD的发生和发展[50].
肠道屏障功能的各个层面相互密切联系, 密不可分, 且与NAFLD的发展密切相关. 现阶段关于肠道屏障功能检测的方法主要如表1所示: (1)病理及形态学观察, 如: 肠绒毛高度、黏膜绒毛高/宽比值、绒毛密度[51]; (2)紧密连接蛋白表达的检测, 如: 紧密连接蛋白ZO-1、occludin等[52-54]; (3)双糖比值测定法, 跨膜细胞电阻测定[54,55], 其中双塘比值测定法是指非代谢性的低聚糖为探针的肠道通透性检测方法, 并以双糖分子乳果糖/甘露醇(Lactulose/Mannitol, L/M)探针最为常用, L/M比值的升高以为着肠道屏障通透性升高, 肠道屏障功能受损; 除了L/M探针外, 检测血浆中D-乳酸、二胺氧化酶(diamine oxidase, DAO)的含量亦是比较常用的方法, 二者的升高均能提示肠道屏障功能受损, 通透性增加. 跨膜细胞电阻测定法多用于肠道屏障损伤的体外模型研究中, 如采用Transwell小室建立的单层Caco-2细胞模型; (4)鲎试剂法测定LPS含量. 血浆内毒素含量的升高是肠道通透性改变和肠黏膜屏障功能障碍的突出表现, 临床上采用很广泛, 具有灵敏度高, 检测方便等优点[56]; (5)q-RT-PCR结合测序分析检测细菌移位情况. 通过收集宿主粪便, 提取其中的基因组DNA, 利用16SrRNA通用引物进行扩增, 建立文库, 对文库数据进行数据分析筛选, 拼接, 最后进行测序分析, 得出其中菌群的α、β多样性, 了解和掌握某一类菌群的功能特点, 该方法不仅能评估肠道屏障功能的损伤与否, 还能对移位的菌群结果进行定性定量的分析, 是后续该方面研究的重要方法[51,57]; (5)酶联免疫吸附法(enzyme-linked immuno sorbent assay, ELISA)测定肠道内分泌性免疫球蛋白A(secretory immunoglobulina, SIgA). SIgA对细菌黏附于肠黏膜细胞起着重要的防御作用. 其水平的下降是评价肠道屏障免疫功能的重要指标[58].
| 方法类型 | 对应文献 |
| 病理及形态学观察 | [51] |
| 紧密连接蛋白表达检测 | [52,53,55] |
| 双糖比值测定法、DAO检测法、跨膜细胞电阻测定 | [53-56] |
| 鲎试剂法LPS测定法 | [57] |
| 16SrRNA测序法 | [51,58] |
| SIgA检测 | [59] |
一般来说, 现阶段治疗NAFD除了运动饮食干预以外, 主要有以下几个切入点: (1)减轻脂质代谢紊乱途径; (2)减缓氧化应激-炎症反应; (3)基于肠道菌群、肠-肝轴的治疗方法. 而近几年, 基于肠道菌群、肠-肝轴的治疗策略越来越引起人们的注意, 其主要包括应用益生元/益生菌, FXR受体激动剂, 菌群移植等[59].
NAFLD的发生发展是多种因素共同作用的结果, 首先肝脏脂质代谢的紊乱, 能量摄入过多是其始动因素, IR作为核心环节, 贯穿于整个NAFLD的病程中. 在此基础上, 氧化应激及广泛的慢性炎症反应是导致NAFLD向NASH甚至肝纤维化, 肝癌发展的重要推动因素. 因此, 降脂、抗炎、抗氧化等依然是当前防治NAFLD的重要手段[60]. 基于该些手段, 已有大量药物应用于临床, 并取得了很好的治疗效果, 如他汀类, 贝特类, 烟酸等胆固醇、脂质代谢调节药物; 普罗布考等具有抗氧化功能的保肝调质药物. 另外, 中药在该环节中具有很重要的地位, 相关药物种类繁多, 疗效确切.
最新的Meta分析结果显示益生菌的治疗能显著地降低肝脏胆固醇及肿瘤坏死因子(tumor necrosis factor, TNF-α)的水平, 并减少胰岛素抵抗, 究其原因, 发现益生菌的治疗能改善肠道菌群的组成, 纠正其结构的紊乱, 下调血清LPS及肝脏TLR4受体表达的水平, 延缓NAFLD的病程[61,62]. 研究发现大多数益生菌都属于双歧杆菌(bifidobacteria)和乳酸杆菌(lactobacillus). 尤其是鼠李糖乳杆菌(lactobacillus rhamnosus)能明显地减少NAFLD患者血清中谷丙转氨酶(alanine aminotransferase, ALT)的水平, 同时还能显著地减轻体重、延缓肝纤维化进程[63]. 同样地, 嗜酸乳杆菌(lactobacillus acidophilus), 双歧杆菌(bifidobacterium), 乳酸菌(lactobacillus), 两岐双岐杆菌(bifidobacterium bifidum)都具有类似的作用[64]. 进一步的研究显示, 益生菌主要是通过减少肠上皮细胞的炎症反应及凋亡, 保护紧密连接蛋白免受破坏, 避免肠道屏障的损伤, 从而起到了防治NAFLD的作用.
益生元泛指具有选择性刺激结肠中一种或几种特定细菌生长或增强其活性, 从而调节肠道菌群结构朝着对机体有益的方向改变, 但本身又不能被机体消化的一类食物. 而关于益生元的作用机制指出其可能通过增强宿主肠道组织的免疫力; 供给肠上皮细胞能量, 加速肠上皮细胞的再生, 促进肠道屏障损伤的修复等. 但相关具体机制还不明确, 有待进一步研究. 现阶段应用和研究较多的益生元是一些非消化性低聚糖(菊粉型果聚糖、低聚半乳糖、大豆低聚糖等), 蛋白质水解物(α乳清蛋白、乳铁蛋白等), 多糖等[65].
粪便微生物的移植(fecal micro-biota transplantation, FMT)现已被应用于临床. 研究显示, 将健康机体的粪便制成混悬液, 并进行一定的处理灌入到患者肠胃中能调节肠道菌群结构的紊乱, 延缓高脂饮食导致的NASH病程的进展. 但目前该方法在临床应用方面还面临一些问题需要解决: 首选, 现阶段用于粪便材料的移植可以通过多种方法注入, 包括鼻胃管、鼻空肠管、上消化道内窥镜(食管胃十二指肠镜)、结肠镜或保留灌肠. 而相关系统回顾研究结果指出不同的方法疗效不一, 且多伴与供者FMT材料的异质性有关[66]. 因此, 粪便菌群移植操作流程还有待进一步规范. 其次, 提供的FMT材料的异质性差异较大. 其主要因素有供体粪便的重量和制备溶液体积以及制备FMT材料的方法. 有研究显示: 经不同溶剂(水、生理盐水、牛奶、其他稀释剂等)处理的FMT, 其治疗效果不同[67]. 另一方面, 由于FMT是一种独特的生物药物, 但又来源于人体, 不属于人体组织器官移植. 总之, FMT要实现大规模应用, 必须要对捐赠者标本进行严格监控和保管, 相关监管机构及法律还有待进一步完善[68,69].
最近的研究显示鹅去氧胆酸的半合成衍生物, 奥贝胆酸(obeticholic acid, OCA)能激活FXR, 减轻NASH病人的肝脏炎症、延缓肝纤维化进程, 与此同时, 在结肠炎的动物模型中, OCA还能减轻肠道炎症, 延缓病情[70]. 但另有研究发现OCA对脂质代谢的调节会有不利的影响, 如升高胆固醇、低密度脂蛋白(low density lipoprotein, LDL)水平, 降低高密度脂蛋白(high density lipoprotein, HDL)水平, 并促进胰岛素抵抗的发生[71]. INT-747作为一个全合成的FXR受体激动剂, 相比OCA, 其药理作用更容易预测[72]. 有研究显示泽泻醇B-23-乙酸酯(alisol B-23-acetate, AB23A)是一种存在于中药泽泻根茎中的天然三萜类化合物, 其能与FXR形成复合物, 促进正常肝细胞增殖, 发挥肝再生、抗胆汁淤积的保肝作用. 说明AB23A具有一定的肝细胞保护作用且通过激活FXR受体产生一定的肠道屏障保护作用[73]. 因此, FXR受体激活途径亦是NAFLD/NASH的一个潜在治疗靶点. 但由于FXR既存在于肠道中又在肝脏中大量表达, 因此后续的相关研究应着重探讨各个组织中FXR受体激活途径在NAFLD/NASH中所扮演的作用及相关机制, 以及在此基础上对糖、脂质代谢等的影响.
总之, 肠-肝轴在非酒精性脂肪肝病发病机制中起至关重要的作用. 良好的肠道稳态对于防治NAFLD的发生发展具有重要作用. 目前, 肠-肝轴功能紊乱与NAFLD方面的联系已在大多数动物模型中得到了验证, 下一步的研究应集中于NAFLD的临床研究, 评估其肠道菌群结构、基因表达谱及与之相对应的蛋白代谢产物之间的关系, 将其与NAFLD病理特征、肠道通透性等相关变化和相关机制进行关联分析, 挖掘出具体菌种在NAFLD发生发展中所扮演的角色, 最终阐明肠-肝轴在NAFLD各个环节过程中的作用机制, 为NAFLD的治疗提供新的思路.
学科分类: 胃肠病学和肝病学
手稿来源地: 广东省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): 0
C级 (良好): C, C
D级 (一般): D
E级 (差): 0
编辑:崔丽君 电编:张砚梁
| 1. | Traussnigg S, Kienbacher C, Halilbasic E, Rechling C, Kazemi-Shirazi L, Hofer H, Munda P, Trauner M. Challenges and Management of Liver Cirrhosis: Practical Issues in the Therapy of Patients with Cirrhosis due to NAFLD and NASH. Dig Dis. 2015;33:598-607. [PubMed] [DOI] |
| 2. | Ferolla SM, Armiliato GN, Couto CA, Ferrari TC. The role of intestinal bacteria overgrowth in obesity-related nonalcoholic fatty liver disease. Nutrients. 2014;6:5583-5599. [PubMed] [DOI] |
| 3. | Fan JG, Farrell GC. Epidemiology of non-alcoholic fatty liver disease in China. J Hepatol. 2009;50:204-210. [PubMed] [DOI] |
| 4. | De Alwis NM, Day CP. Non-alcoholic fatty liver disease: the mist gradually clears. J Hepatol. 2008;48 Suppl 1:S104-S112. [PubMed] [DOI] |
| 6. | 南 月敏, 付 娜, 李 文聪, 孔 令波, 苑 喜微, 张 思雨, 刘 领弟, 路 宇, 崔 璐瑶. 2017美国非酒精性脂肪性肝病诊断与管理指南解读. 中华肝脏病杂志. 2017;9:687-694. [DOI] |
| 10. | Day CP, James OF. Steatohepatitis: a tale of two "hits"? Gastroenterology. 1998;114:842-845. [PubMed] |
| 12. | Balaban YH, Aka C, Koca-Caliskan U. Liver immunology and herbal treatment. World J Hepatol. 2017;9:757-770. [PubMed] [DOI] |
| 13. | Gao B, Jeong WI, Tian Z. Liver: An organ with predominant innate immunity. Hepatology. 2008;47:729-736. [PubMed] [DOI] |
| 15. | Bliss SK, Bliss SP, Beiting DP, Alcaraz A, Appleton JA. IL-10 regulates movement of intestinally derived CD4+ T cells to the liver. J Immunol. 2007;178:7974-7983. [PubMed] |
| 16. | Douglas DB, Beiting DP, Loftus JP, Appleton JA, Bliss SK. Combinatorial effects of interleukin 10 and interleukin 4 determine the progression of hepatic inflammation following murine enteric parasitic infection. Hepatology. 2010;51:2162-2171. [PubMed] [DOI] |
| 17. | Wigg AJ, Roberts-Thomson IC, Dymock RB, McCarthy PJ, Grose RH, Cummins AG. The role of small intestinal bacterial overgrowth, intestinal permeability, endotoxaemia, and tumour necrosis factor alpha in the pathogenesis of non-alcoholic steatohepatitis. Gut. 2001;48:206-211. [PubMed] |
| 18. | O'Leary DP, Bhatt L, Woolley JF, Gough DR, Wang JH, Cotter TG, Redmond HP. TLR-4 signalling accelerates colon cancer cell adhesion via NF-κB mediated transcriptional up-regulation of Nox-1. PLoS One. 2012;7:e44176. [PubMed] [DOI] |
| 19. | Jones RM, Neish AS. Redox signaling mediated by the gut microbiota. Free Radic Biol Med. 2017;105:41-47. [PubMed] [DOI] |
| 20. | Jones RM, Neish AS. Redox signaling mediated by the gut microbiota. Free Radic Biol Med. 2017;105:41-47. [PubMed] [DOI] |
| 21. | Zorn AM, Wells JM. Vertebrate endoderm development and organ formation. Annu Rev Cell Dev Biol. 2009;25:221-251. [PubMed] [DOI] |
| 22. | Paolella G, Mandato C, Pierri L, Poeta M, Di Stasi M, Vajro P. Gut-liver axis and probiotics: their role in non-alcoholic fatty liver disease. World J Gastroenterol. 2014;20:15518-15531. [PubMed] [DOI] |
| 23. | 杨 珍妮, 刘 丹, 刘 冰熔. 肠道菌群失调与众多消化系统疾病关系密切, 包括慢性腹泻、胰腺炎、肝硬化、肠易激综合征(irritable bowel syndrome, IBS)、炎症性肠病(inflammatory bowel disease, IBD), 甚至CRC. 世界华人消化杂志. 2014;22:2547-2552. [DOI] |
| 26. | Crane RJ, Jones KD, Berkley JA. Environmental enteric dysfunction: an overview. Food Nutr Bull. 2015;36:S76-S87. [PubMed] [DOI] |
| 27. | Gómez-Hurtado I, Such J, Sanz Y, Francés R. Gut microbiota-related complications in cirrhosis. World J Gastroenterol. 2014;20:15624-15631. [PubMed] [DOI] |
| 29. | Yuan J, Zeng B, Niu R, Tang H, Li W, Zhang Z, Wei H. The development and stability of the genus Bacteriodes from human gut microbiota in HFA mice model. Curr Microbiol. 2011;62:1107-1112. [PubMed] [DOI] |
| 30. | Garland SH. Short chain fatty acids may elicit an innate immune response from preadipocytes: a potential link between bacterial infection and inflammatory diseases. Med Hypotheses. 2011;76:881-883. [PubMed] [DOI] |
| 31. | Rooks MG, Garrett WS. Gut microbiota, metabolites and host immunity. Nat Rev Immunol. 2016;16:341-352. [PubMed] [DOI] |
| 32. | Maslowski KM, Mackay CR. Diet, gut microbiota and immune responses. Nat Immunol. 2011;12:5-9. [PubMed] [DOI] |
| 33. | Vinolo MA, Rodrigues HG, Hatanaka E, Sato FT, Sampaio SC, Curi R. Suppressive effect of short-chain fatty acids on production of proinflammatory mediators by neutrophils. J Nutr Biochem. 2011;22:849-855. [PubMed] [DOI] |
| 34. | Park JS, Lee EJ, Lee JC, Kim WK, Kim HS. Anti-inflammatory effects of short chain fatty acids in IFN-gamma-stimulated RAW 264.7 murine macrophage cells: involvement of NF-kappaB and ERK signaling pathways. Int Immunopharmacol. 2007;7:70-77. [PubMed] [DOI] |
| 35. | Zhang WH, Jiang Y, Zhu QF, Gao F, Dai SF, Chen J, Zhou GH. Sodium butyrate maintains growth performance by regulating the immune response in broiler chickens. Br Poult Sci. 2011;52:292-301. [PubMed] [DOI] |
| 36. | Smith PM, Howitt MR, Panikov N, Michaud M, Gallini CA, Bohlooly-Y M, Glickman JN, Garrett WS. The microbial metabolites, short-chain fatty acids, regulate colonic Treg cell homeostasis. Science. 2013;341:569-573. [PubMed] [DOI] |
| 37. | 周 达, 范 建高. 肠道菌群-SCFAs在代谢性疾病中的作用研究. 胃肠病学和肝病学杂志. 2016;25:330-332. [DOI] |
| 38. | Den Besten G, Bleeker A, Gerding A, van Eunen K, Havinga R, van Dijk TH, Oosterveer MH, Jonker JW, Groen AK, Reijngoud DJ. Short-Chain Fatty Acids Protect Against High-Fat Diet-Induced Obesity via a PPARγ-Dependent Switch From Lipogenesis to Fat Oxidation. Diabetes. 2015;64:2398-2408. [PubMed] [DOI] |
| 39. | Zhu L, Baker SS, Gill C, Liu W, Alkhouri R, Baker RD, Gill SR. Characterization of gut microbiomes in nonalcoholic steatohepatitis (NASH) patients: a connection between endogenous alcohol and NASH. Hepatology. 2013;57:601-609. [PubMed] [DOI] |
| 40. | Baker SS, Baker RD, Liu W, Nowak NJ, Zhu L. Role of alcohol metabolism in non-alcoholic steatohepatitis. PLoS One. 2010;5:e9570. [PubMed] [DOI] |
| 41. | Poeta M, Pierri L, Vajro P. Gut-Liver Axis Derangement in Non-Alcoholic Fatty Liver Disease. Children (Basel). 2017;4:66. [PubMed] [DOI] |
| 43. | Wahlström A, Kovatcheva-Datchary P, Ståhlman M, Bäckhed F, Marschall HU. Crosstalk between Bile Acids and Gut Microbiota and Its Impact on Farnesoid X Receptor Signalling. Dig Dis. 2017;35:246-250. [PubMed] [DOI] |
| 44. | Chávez-Talavera O, Tailleux A, Lefebvre P, Staels B. Bile Acid Control of Metabolism and Inflammation in Obesity, Type 2 Diabetes, Dyslipidemia, and Nonalcoholic Fatty Liver Disease. Gastroenterology. 2017;152:1679-1694.e3. [PubMed] [DOI] |
| 45. | Begley M, Hill C, Gahan CG. Bile salt hydrolase activity in probiotics. Appl Environ Microbiol. 2006;72:1729-1738. [PubMed] [DOI] |
| 46. | Gonzalez FJ, Jiang C, Patterson AD. An Intestinal Microbiota-Farnesoid X Receptor Axis Modulates Metabolic Disease. Gastroenterology. 2016;151:845-859. [PubMed] [DOI] |
| 47. | Fang S, Suh JM, Reilly SM, Yu E, Osborn O, Lackey D, Yoshihara E, Perino A, Jacinto S, Lukasheva Y. Intestinal FXR agonism promotes adipose tissue browning and reduces obesity and insulin resistance. Nat Med. 2015;21:159-165. [PubMed] [DOI] |
| 48. | Kirpich IA, Marsano LS, McClain CJ. Gut-liver axis, nutrition, and non-alcoholic fatty liver disease. Clin Biochem. 2015;48:923-930. [PubMed] [DOI] |
| 49. | Luther J, Garber JJ, Khalili H, Dave M, Bale SS, Jindal R, Motola DL, Luther S, Bohr S, Jeoung SW. Hepatic Injury in Nonalcoholic Steatohepatitis Contributes to Altered Intestinal Permeability. Cell Mol Gastroenterol Hepatol. 2015;1:222-232. [PubMed] [DOI] |
| 50. | Begley M, Gahan CG, Hill C. The interaction between bacteria and bile. FEMS Microbiol Rev. 2005;29:625-651. [PubMed] [DOI] |
| 51. | Wu ZX, Li SF, Chen H, Song JX, Gao YF, Zhang F, Cao CF. The changes of gut microbiota after acute myocardial infarction in rats. PLoS One. 2017;12:e0180717. [PubMed] [DOI] |
| 52. | Mir H, Meena AS, Chaudhry KK, Shukla PK, Gangwar R, Manda B, Padala MK, Shen L, Turner JR, Dietrich P. Occludin deficiency promotes ethanol-induced disruption of colonic epithelial junctions, gut barrier dysfunction and liver damage in mice. Biochim Biophys Acta. 2016;1860:765-774. [PubMed] [DOI] |
| 53. | Kumar D, Pandey G, Bansal D, Rawat A, Kumar U, Dubey D, Guleria A, Saraswat VA. NMR-based urinary profiling of lactulose/mannitol ratio used to assess the altered intestinal permeability in acute on chronic liver failure (ACLF) patients. Magn Reson Chem. 2017;55:289-296. [PubMed] [DOI] |
| 54. | Xu J, Liu Z, Zhan W, Jiang R, Yang C, Zhan H, Xiong Y. Recombinant TsP53 modulates intestinal epithelial barrier integrity via upregulation of ZO1 in LPSinduced septic mice. Mol Med Rep. 2018;17:1212-1218. [PubMed] [DOI] |
| 55. | Kasper JY, Hermanns MI, Cavelius C, Kraegeloh A, Jung T, Danzebrink R, Unger RE, Kirkpatrick CJ. The role of the intestinal microvasculature in inflammatory bowel disease: studies with a modified Caco-2 model including endothelial cells resembling the intestinal barrier in vitro. Int J Nanomedicine. 2016;11:6353-6364. [PubMed] [DOI] |
| 56. | Kim S, Goel R, Kumar A, Qi Y, Lobaton G, Hosaka K, Mohammed M, Handberg EM, Richards EM, Pepine CJ. Imbalance of gut microbiome and intestinal epithelial barrier dysfunction in patients with high blood pressure. Clin Sci (Lond). 2018;132:701-718. [PubMed] [DOI] |
| 57. | Bajaj JS, Kakiyama G, Zhao D, Takei H, Fagan A, Hylemon P, Zhou H, Pandak WM, Nittono H, Fiehn O. Continued Alcohol Misuse in Human Cirrhosis is Associated with an Impaired Gut-Liver Axis. Alcohol Clin Exp Res. 2017;41:1857-1865. [PubMed] [DOI] |
| 58. | Wu J, Chen J, Wu W, Shi J, Zhong Y, van Tol EA, Tang Q, Cai W. Enteral supplementation of bovine lactoferrin improves gut barrier function in rats after massive bowel resection. Br J Nutr. 2014;112:486-492. [PubMed] [DOI] |
| 59. | Cani PD, Bibiloni R, Knauf C, Waget A, Neyrinck AM, Delzenne NM, Burcelin R. Changes in gut microbiota control metabolic endotoxemia-induced inflammation in high-fat diet-induced obesity and diabetes in mice. Diabetes. 2008;57:1470-1481. [PubMed] [DOI] |
| 60. | Min HK, Kapoor A, Fuchs M, Mirshahi F, Zhou H, Maher J, Kellum J, Warnick R, Contos MJ, Sanyal AJ. Increased hepatic synthesis and dysregulation of cholesterol metabolism is associated with the severity of nonalcoholic fatty liver disease. Cell Metab. 2012;15:665-674. [PubMed] [DOI] |
| 61. | Ma Y, Huang Y, Yan L, Gao M, Liu D. Synthetic FXR agonist GW4064 prevents diet-induced hepatic steatosis and insulin resistance. Pharm Res. 2013;30:1447-1457. [PubMed] [DOI] |
| 62. | Xue L, He J, Gao N, Lu X, Li M, Wu X, Liu Z, Jin Y, Liu J, Xu J. Probiotics may delay the progression of nonalcoholic fatty liver disease by restoring the gut microbiota structure and improving intestinal endotoxemia. Sci Rep. 2017;7:45176. [PubMed] [DOI] |
| 63. | Vajro P, Mandato C, Veropalumbo C, De Micco I. Probiotics: a possible role in treatment of adult and pediatric non alcoholic fatty liver disease. Ann Hepatol. 2013;12:161-163. [PubMed] |
| 64. | Vajro P, Veropalumbo C, D'Aniello R, Mandato C. Probiotics in the treatment of non alcoholic fatty liver disease: further evidence in obese children. Nutr Metab Cardiovasc Dis. 2013;23:e9-10. [PubMed] [DOI] |
| 66. | Smits LP, Bouter KE, de Vos WM, Borody TJ, Nieuwdorp M. Therapeutic potential of fecal microbiota transplantation. Gastroenterology. 2013;145:946-953. [PubMed] [DOI] |
| 67. | Vrieze A, Van Nood E, Holleman F, Salojärvi J, Kootte RS, Bartelsman JF, Dallinga-Thie GM, Ackermans MT, Serlie MJ, Oozeer R. Transfer of intestinal microbiota from lean donors increases insulin sensitivity in individuals with metabolic syndrome. Gastroenterology. 2012;143:913-916.e7. [PubMed] [DOI] |
| 68. | Rotman Y, Sanyal AJ. Current and upcoming pharmacotherapy for non-alcoholic fatty liver disease. Gut. 2017;66:180-190. [PubMed] [DOI] |
| 69. | Megerlin F, Fouassier E. Faecal microbiota transplantation in France: what applicable law? Ann Pharm Fr. 2014;72:363-374. [PubMed] [DOI] |
| 70. | Neuschwander-Tetri BA, Loomba R, Sanyal AJ, Lavine JE, Van Natta ML, Abdelmalek MF, Chalasani N, Dasarathy S, Diehl AM, Hameed B. Farnesoid X nuclear receptor ligand obeticholic acid for non-cirrhotic, non-alcoholic steatohepatitis (FLINT): a multicentre, randomised, placebo-controlled trial. Lancet. 2015;385:956-965. [PubMed] [DOI] |
| 71. | Gege C, Kinzel O, Steeneck C, Schulz A, Kremoser C. Knocking on FXR's door: the "hammerhead"-structure series of FXR agonists - amphiphilic isoxazoles with potent in vitro and in vivo activities. Curr Top Med Chem. 2014;14:2143-2158. [PubMed] [DOI] |
| 72. | Mudaliar S, Henry RR, Sanyal AJ, Morrow L, Marschall HU, Kipnes M, Adorini L, Sciacca CI, Clopton P, Castelloe E. Efficacy and safety of the farnesoid X receptor agonist obeticholic acid in patients with type 2 diabetes and nonalcoholic fatty liver disease. Gastroenterology. 2013;145:574-582.e1. [PubMed] [DOI] |
| 73. | Li J, Pircher PC, Schulman IG, Westin SK. Regulation of complement C3 expression by the bile acid receptor FXR. J Biol Chem. 2005;280:7427-7434. [PubMed] [DOI] |