修回日期: 2017-03-02
接受日期: 2017-03-13
在线出版日期: 2017-04-18
初步探讨二甲双胍(metformin, MET)诱导人肝癌HepG2细胞凋亡的分子机制.
将不同浓度的MET(0-20 mmol/L)作用于HepG2细胞24 h或10 mmol/LMET作用于HepG2细胞不同时间(0-48 h), 采用MTT法测定MET抑制细胞增殖效应. 将HepG2细胞暴露于不同浓度的MET(0-20 mmol/L)作用24 h或10 mmol/L MET不同时间(0-48 h), 用Annexin V-FITC/PI流式双染来测定其细胞凋亡率; 用RT-PCR检测不同浓度MET作用于HepG2细胞或相同浓度作用于HepG2细胞不同时间后血管内皮生长因子(vascular endothelial growth factor, VEGF)表达的变化, 以了解MET诱导HepG2细胞凋亡与VEGF的关系.
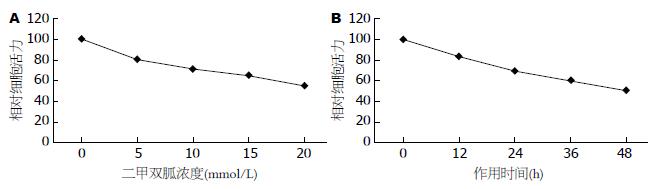
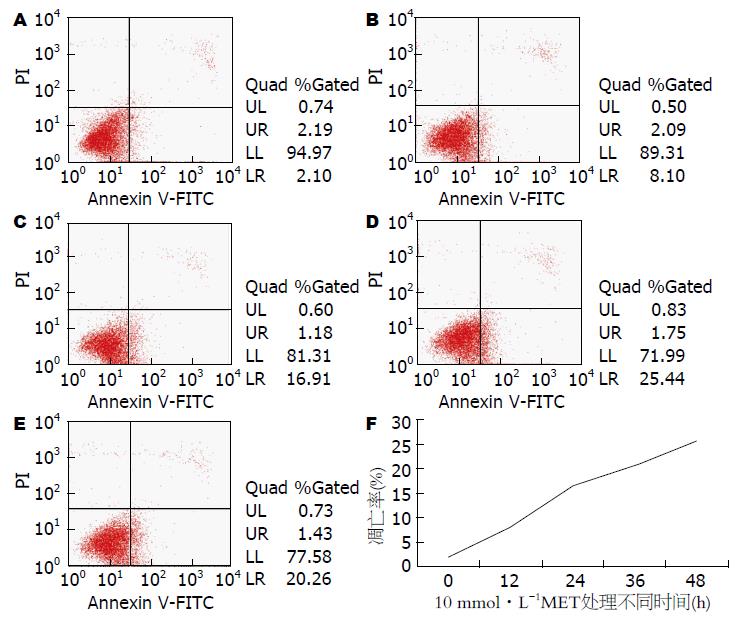
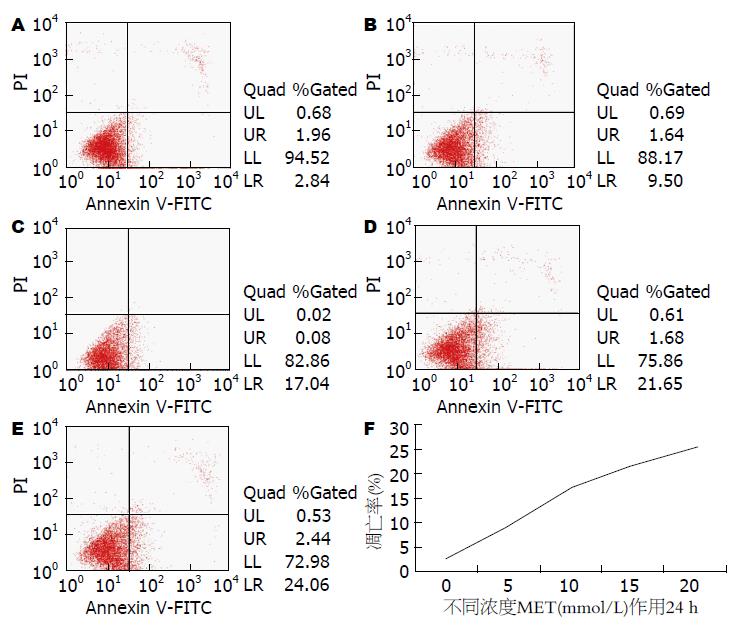
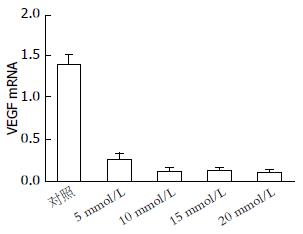
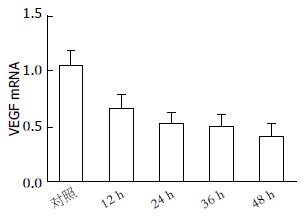
MET对HepG2细胞生长有明显的抑制作用. 不同浓度MET(0、5、10、15、20 mmol/L)处理HepG2细胞24 h后, 其相对细胞活力分别为100%、80.56%±0.72%、71.06%±0.70%、64.73%±0.35%、54.73%±0.40%, 呈现浓度依赖性; 10 mmol/L MET作用于HepG2细胞0、12、24、36、48 h后, 其相对相对细胞活力分别为100%、83.40%±0.70%、69.86%±0.45%、60.40%±0.88%、50.70%±0.45%, 呈现时间依赖性. 不同浓度MET(0、5、10、15、20 mmol/L)处理HepG2细胞24 h后, Annexin V-FITC/PI流式双染提示细胞凋亡明显增加, 其凋亡率分别为2.78%±0.68%、9.33%±0.22%、17.13%±0.10%、21.61%±0.20%、25.26%±1.09%, 呈现浓度依赖性; 10 mmol/LMET作用于HepG2细胞12、24、36、48 h后, Annexin V-FITC/PI流式双染提示细胞凋亡明显增加, 其凋亡率分别为2.05%±0.04%、8.10%±0.08%、16.53%±0.93%、20.95%±0.16%、25.65%±0.44%, 呈现时间依赖性. 随着MET浓度的升高或作用时间延长, VEGF的表达均减少, 呈现剂量或时间依赖性.
二甲双胍可以通过诱导HepG2细胞凋亡来抑制其增殖, 其过程可能与抑制VEGF的表达有关.
核心提要: 二甲双胍可以减少多种恶性肿瘤的发生及肿瘤相关性死亡已得广泛证实. 本文通过体外实验证实二甲双胍可以诱导HepG2细胞凋亡, 对未来肝癌的治疗提供新思路.
引文著录: 叶艳清, 张蕾, 谢军, 朱海燕, 谢云, 曾斌. VEGF在二甲双胍诱导HepG2细胞凋亡的作用. 世界华人消化杂志 2017; 25(11): 966-973
Revised: March 2, 2017
Accepted: March 13, 2017
Published online: April 18, 2017
To investigate the molecular mechanism of metformin induced apoptosis of HepG2 cells.
HepG2 cells were treated with different concentrations (0-20 mmol/L) of metformin (MET) for 24 h or 10 mmol/L MET for different times (0-48 h), and the effect of MET on cell proliferation was measured by MTT assay. Annexin V-FITC/PI flow cytometry was used to determine the apoptosis rate. RT-PCR was used to analyze the expression of vascular endothelial growth factor (VEGF) in HepG2 cells treated with MET.
MET had an obvious inhibitory effect on HepG2 cell proliferation. After treatment with 0, 5, 10, 15, and 20 mmol/L MET for 24 h, the relative cell viability rates of HepG2 cells were 100%, 80.56% ± 0.72%, 71.06% ± 0.70%, 64.73% ± 0.35%, and 54.73% ± 0.40%, respectively, showing a dose-dependent manner. After treatment with 10 mmol/L MET for 0, 12, 24, 36, and 48 h, the relative cell viability rates of HepG2 cells were 100%, 83.40% ± 0.70%, 69.86% ± 0.45%, 60.40% ± 0.88%, and 50.70% ± 0.45%, respectively, showing a time-dependent manner. Annexin V-FITC/PI flow cytometry revealed that the apoptosis rates of HepG2 cell were increased after treatment with 0, 5, 10, 15, and 20 mmol/L MET for 24 h, and the apoptosis rates were 2.78% ± 0.68%, 9.33% ± 0.22%, 17.13% ± 0.10%, 21.61% ± 0.20%, and 25.26% ± 1.09%, respectively, showing a dose-dependent manner. The apoptosis rates of HepG2 cells were increased after treatment with 10 mmol/L for 0, 12, 24, 36, 48 h, and the apoptosis rates were 2.05% ± 0.04%, 8.10% ± 0.08%, 16.53% ± 0.93%, 20.95% ± 0.16%, and 25.65% ± 0.44%, showing a time-dependent manner. The expression of VEGF decreased after treatment with different concentrations of MET for 24 h or 10 mmol/L MET for different times, showing a dose- and time-dependent manner.
MET can inhibit HepG2 cell proliferation via inducing apoptosis, which may involve the expression of VEGF.
- Citation: Ye YQ, Zhang L, Xie J, Zhu HY, Xie Y, Zeng B. Role of VEGF in metformin induced apoptosis of HepG2 cells. Shijie Huaren Xiaohua Zazhi 2017; 25(11): 966-973
- URL: https://www.wjgnet.com/1009-3079/full/v25/i11/966.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v25.i11.966
肝癌的发病率居常见恶性肿瘤第5位, 居恶性肿瘤相关死因第3位[1]. 在发达国家, 由于生活水平高及西方生活习惯, 酒精性及非酒精性脂肪性肝病急剧增加, 使肝癌的发病率持续攀升; 而在发展中国家, 则由于乙肝和丙肝病毒的感染率较高, 肝癌的新发病例也持续增加, 其中中国占一半以上. 肝癌的治疗主要分为手术治疗、介入治疗、放射治疗、生物治疗、中医中药治疗及综合治疗等[2]. 手术切除是早期肝癌的唯一有效方法. 但早期肝癌往往没有明显的症状, 而当患者出现症状就诊时大多数已经丧失了手术治疗的机会. 因此, 寻找综合治疗尤其是化学治疗的新方法显得十分重要.
近年来, 由于生活水平的提高, 肥胖、代谢综合征及糖尿病等慢性病成为全世界的常见病、多发病; 大量的流行病学调查表明, 糖尿病不仅与血管病变的发展有关, 而且与多种恶性肿瘤如胰腺癌、乳腺癌、肝癌、结直肠癌发生密切相关[3-6]. 有趣的是, 流行病学与临床观察显示二甲双胍降低多种肿瘤的发病率, 改善合并2型糖尿病的肿瘤患者的预后并能提高生存率[7]. 大量前瞻性及回顾性研究均证实, 与不用二甲双胍的糖尿病患者比较, 用二甲双胍治疗的糖尿病患者发生肝癌、肺癌、胰腺癌等恶性肿瘤风险降低, 还发现二甲双胍应用可减少多种恶性肿瘤死亡风险, 延长生存时间, 改善预后; 另外, 在正常剂量范围内, 使用时间越长及剂量越大, 肿瘤的发生率进一步降低. 因此, 二甲双胍有望成为一个新的肿瘤治疗药物或辅助抗肿瘤药物. 新近, 体外实验也证实, 二甲双胍抑制多种肝癌细胞株如HepG2、SMC-7721、Huh-7、Bel-7402等的增殖, 甚至诱导其凋亡, 其机制却不完全清楚, 可能与细胞周期阻滞、激活MAPK、抑制mTOR通路等相关[8-10]. 肿瘤的主要特征是肿瘤细胞的快速生长并伴有远处转移. 肿瘤的生长、侵袭、转移与肿瘤的新生血管密切相关. 血管内皮生长因子(vascular endothelial growth factor, VEGF)是目前已知作用最强的血管生成诱导因子, VEGF有抑制肿瘤细胞凋亡的作用[11]. 例如VEGF可诱导抗凋亡蛋白Bcl-2的表达, 直接抑制肿瘤细胞的凋亡, 同时增强肿瘤细胞对放疗的耐受性及影响免疫功能. 肝癌是典型的富血管肿瘤, 理论上通过抑制VEGF对抗肿瘤意义重大. 大量的临床流行病学研究证实, 二甲双胍可减少肝癌的发生及肝癌相关死亡. 我们早期体外研究也证实, 二甲双胍可抑制HepG2增殖, 但其机制仍不明确.
本研究通过观察不同浓度二甲双胍对肝癌HepG2细胞凋亡、VEGF及相关凋亡蛋白表达的影响, 初步探讨VEGF在二甲双胍诱导HepG2细胞凋亡中的作用, 为其成为未来安全有效的肝癌预防与治疗药物提供初步理论依据, 为肝癌的防治及转移提供新思路.
DMEM培养基(GIBCO公司, 美国); 胎牛血清(BI生物有限公司); 二甲双胍(metformin, Amerco公司); 0.25%胰蛋白酶(凯基生物有限公司); Annexin V-FITC/PI凋亡检测试剂盒(Yeasen, 美国); Zon Reagent TRIzol总RNA提取试剂盒、HiFiScript cDNA第一链合成试剂盒(CWBIO康为世纪).
1.2.1 细胞培养: HepG2细胞培养于含10%胎牛血清的DMEM培养基(含青、链霉素各100 IU/L)中, 3 d传代1次, 用0.25%的胰酶和0.01%EDTA溶液消化后, 按一比三传代到25 cm2培养瓶中培养, 单层培养和孵化于培养箱中, 在37 ℃、95%湿度和50 mL/L CO2的条件下进行培养, 24 h后进行各项预处理. MTT细胞存活力测定则传代于96孔板中.
1.2.2 细胞存活率测定: 细胞按每孔5×103个细胞在200 μL培养基中传代至96孔板中, 生长12 h后弃原培养基, 不同浓度组分别加入0、5、10、15、20 mmol/L MET培养基进行培养, 每孔设6个复孔, 并设调零孔; 24 h后每孔分别加入20 μL MTT(5 g/L), 继续孵育4 h后弃培养基, 加入150 μL DMSO, 避光剧烈振荡5 min后, 用酶标仪在492 nm处测吸光值; 不同时间组则分别在培养12 h后弃原培养基后, 每孔设6个复孔, 并设调零孔, 48 h组加入含10 mmol/L MET培养基, 以后每隔12 h分别再次取1组加入后含10 mmol/L MET培养基, 直至48 h后每孔分别加入20 μL MTT(5 g/L), 继续孵育4 h后弃培养基, 加入150 μL DMSO, 避光剧烈振荡5 min后, 用酶标仪在492 nm处测吸光值, 相对细胞活力计算为加药处理组的吸光值与未加药正常组吸光值的比值.
1.2.3 Annexin V-FITC/PI双染流式细胞仪检测细胞凋亡率: 用Annexin V-FITC/PI双染流式细胞仪测定细胞凋亡率, 分不同浓度MET作用24 h组及10 mmol/L处理不同时间组. 按要求对细胞进行预处理后, 用0.25%的胰酶消化细胞后收集细胞. 加入300 μL的1×Binding Buffer悬浮细胞; 加入5 μL的Annexin V-FITC混匀后, 避光, 室温孵育15 min; 上机前5 min再加入5 μL的PI染色; 最后补加200 μL的1×Binding Buffer进行上机检测细胞凋亡率.
1.2.4 荧光定量PCR测定VEGF相对表达量情况: 从UCSC基因组数据库网站(http://genome.ucsc.edu/index.html)检索VEGF基因序列, 引物设计使用Primer 3.0在线软件, 并委托上海生工公司合成(序列如下: VEGF正向引物序列: GCACATAGAGAGAATGAGCTTCC; 反向引物序列: CTCCGCTCTGAACAAGGCT; β-actin正向引物序列: ATCGTCCACCGTAAATGC; 反向引物序列: TGAAGTGGTAGTCGGGTG). 不同浓度MET(0、5、10、15、20 mmol/L)与细胞孵育24 h或用10 mmol/L MET处理细胞0-48 h. 在细胞被处理后, 经过以下步骤: 总RNA的提取(Zon Reagent TRIzol总RNA提取试剂盒)、cDNA的合成(HiFiScript cDNA试剂盒)、用合成的cDNA进行荧光定量PCR. 荧光定量PCR步骤: (1)向96孔板中加入反应混合液10 μL、相应引物0.5 μL、cDNA 2 μL、水7.5 μL; (2)每个反应在同一块反应板中至少重复2次; (3)加样后, 在RT-PCR仪中按以下反应: 95 ℃ 3 min、95 ℃ 10 s、50 ℃ 30 s、72 ℃ 30 s、40个循环. 反应完成后, 荧光定量PCR仪反应程序将提供每个反应孔在同一"门槛"下的Ct值.
统计学处理 所有的实验均重复3次, 各组数据均用mean±SD表示, 各组均数用SPSS16.0软件进行非配对t检验或单因素方差分析. P<0.05为差异具有统计学意义.
MET处理HepG2细胞后, 细胞相对存活率明显下降, 并且呈现剂量和时间依赖性. 从图1可以看出, 0、5、10、15、20 mmol/L MET浓度组细胞相对活力分别为100%、80.56%±0.72%、71.06%±0.70%、64.73%±0.35%、54.73%±0.40%(P<0.05); 从图1可以看出, 10 mmol/L MET处理细胞0、12、24、36、48 h后, 其细胞相对活力分别为100%、83.40%±0.70%、69.86%±0.45%、60.40%±0.88%、50.70%±0.45%(P<0.05).
不同浓度的MET(0、5、10、15、20 mmol/L)处理HepG2细胞24 h后, 随着MET浓度的升高, Annexin V-FITC/PI双染流式细胞仪检测细胞凋亡率明显增加, 其凋亡率分别为2.78%±0.68%、9.33%±0.22%、17.13%±0.10%、21.61%±0.20%、25.26%±1.09%(P<0.05, 图2), 呈现剂量依赖性; 用10 mmol/L MET处理HepG2细胞不同的时间(0、12、24、36、48 h)后, Annexin V-FITC/PI双染流式细胞仪检测细胞凋亡率明显增加, 其凋亡率分别为2.05%±0.04%、8.10%±0.08%、16.53%±0.93%、20.95%±0.16%、25.65%±0.44%(P<0.05, 图3), 呈现剂量依赖性.
二甲双胍作为一种非常有效的降血糖药物, 数十年来广泛用于治疗2型糖尿病. 相对于其他口服降糖药物及胰岛素而言, 二甲双胍具有服用方便、没有低血糖的不良反应及不增加患者体质量等特点. 近年来, 随着临床流行病学研究的广泛兴起, 二甲双胍对多种恶性肿瘤患者可能有一定的保护作用; 其表现为与不服用二甲双胍患者相比, 服用二甲双胍可以减少恶性肿瘤的发生率、延缓恶性肿瘤进展及转移、减少恶性肿瘤相关性死亡或延长恶性肿瘤患者的生命[12,13]. 流行病学调查显示, 使用二甲双胍治疗的2型糖尿病患者发生恶性肿瘤风险明显下降, 并对恶性肿瘤患者的预后有所改善[14,15], 研究涉及有前列腺癌, 乳腺癌癌, 胰腺癌, 卵巢癌, 肺癌, 胃癌及肝癌等[16-22]. 体外实验研究也有证实, 二甲双胍可抑制多种恶性肿瘤细胞株如MDA-MB-231[23]、ESCC[24]及Huh7[25]的增殖甚至发生凋亡, 但对HepG2细胞却鲜有报道. 本研究首先通过MTT法证实MET抑制HepG2细胞增殖呈现剂量和时间依赖性, 即表明MET对HepG2细胞具有增殖抑制作用. 抑制细胞增殖作用可分为诱导细胞发生坏死或凋亡, 凋亡细胞可表现为细胞膜磷脂酰丝氨酸由脂膜内侧翻向外侧, 且这一变化早于细胞皱缩、染色质浓缩、DNA片断化和细胞膜的通透性增加等凋亡现象; 本研究中, 我们为了证实抑制细胞增殖是否发生凋亡, 我们用Annexin V-FITC/PI双染处理细胞后, 通过流式细胞仪检测, 结果证实, 二甲双胍处理HepG2细胞后, 凋亡率明显增加, 提示二甲双胍抑制HepG2细胞增殖主要是通过诱导凋亡来实现.
VEGF是目前最强的促进血管生长的细胞因子之一, 在许多恶性肿瘤的发生、进展、转移及预后起重要作用[26,27]. 目前许多研究证实, 肿瘤组织表达VEGF明显较正常组织高; 也有研究证实, 肿瘤的转移患者表达较未转移患者明显高[28]. 因此, 关于VEGF与肿瘤的关系成为近年研究的热点. Ersoy等[29]发现, 二甲双胍可以减少糖尿病患者血清VEGF水平, 提示二甲双胍可能有一定抑制VEGF表达的作用. 同时也有研究[30]发现, 二甲双胍可以增加VEGF的降解来延缓糖尿病肾病的进展. 在胰腺癌细胞中, 二甲双胍可以下调VEGF-B的表达来增强白藜芦醇的抗肿瘤作用[31]; 提示二甲双胍抗肿瘤作用可能与下调VEGF的表达有关. 而我们的研究发现, MET处理后, HepG2细胞表达VEGF减少, 提示VEGF可能参与MET诱导HepG2细胞凋亡过程.
总之, MET可以诱导HepG2细胞凋亡, 其过程可能有抑制VEGF表达的参与, 但其详细机制有待进一步研究.
肝癌是常见的恶性肿瘤, 居恶性肿瘤相关性死因第3位. 目前肝癌的治疗方法为手术、介入及放化疗, 但效果均久佳. 二甲双胍是一种临床上最常用的降血糖药物, 近年来其抗肿瘤作用及减少肿瘤相关性死亡引起了研究者的关注.
本研究发现, 二甲双胍诱导HepG2细胞凋亡可能与血管内皮生长因子(vascular endothelial growth factor, VEGF)有关, 提示肝癌的发生及发展与VEGF密切相关, 为以后研发新的药物提供一定参考.
Zhang等通过大量流行病学证实, 与不服用二甲双胍相比, 服用二甲双胍可以减少糖尿病患者发生肝癌, 但机制不明. 本研究通过体外实验, 拟进一步揭示其可能机制.
本文通过实验证实了二甲双胍可以诱导HepG2细胞凋亡后, 再进一步证实此过程可能与VEGF的表达减少有关, 从而为以后的研究提供方向.
本研究通过体外实验证实, 二甲双胍诱导HepG2细胞凋亡可能与VEGF有关, 可能为以后开发相关肝癌治疗药物提供理论参考.
向晓星, 主任医师, 苏北人民医院消化科, 扬州大学临床医学院; 许钟, 副主任医师, 贵州省人民医院消化内科
本研究证实二甲双胍诱导HepG2细胞凋亡可能与VEGF有关, 给未来进一步揭示二甲双胍诱导HepG2细胞凋亡有一定参考, 甚至对研发相关药物提供了理论依据.
手稿来源: 自由投稿
学科分类: 胃肠病学和肝病学
手稿来源地: 江西省
同行评议报告分类
A级 (优秀): 0
B级 (非常好): B
C级 (良好): C
D级 (一般): 0
E级 (差): 0
编辑:闫晋利 电编:李瑞芳
| 1. | Soldera J, Balbinot SS, Balbinot RA, Cavalcanti AG. Diagnostic and Therapeutic Approaches to Hepatocellular Carcinoma: Understanding the Barcelona Clínic Liver Cancer Protocol. Clin Med Insights Gastroenterol. 2016;9:67-71. [PubMed] [DOI] |
| 2. | Pinter M, Trauner M, Peck-Radosavljevic M, Sieghart W. Cancer and liver cirrhosis: implications on prognosis and management. ESMO Open. 2016;1:e000042. [PubMed] [DOI] |
| 3. | Bershteĭn LM, Ievleva AG, Vasil'ev DA, Kovalenko IM, Imianitov EN. [Potential sensitivity to metformin of the diabetics suffering and not suffering with cancer: a pharmacogenetic study]. Vestn Ross Akad Med Nauk. 2013;58-63. [PubMed] |
| 4. | Aung KL, Moore MJ. Metformin for pancreatic cancer. Lancet Oncol. 2015;16:748-749. [PubMed] [DOI] |
| 5. | Anisimov VN. Metformin for Prevention and Treatment of Colon Cancer: A Reappraisal of Experimental and Clinical Data. Curr Drug Targets. 2016;17:439-446. [PubMed] |
| 6. | Al Hilli MM, Bakkum-Gamez JN, Mariani A, Cliby WA, Mc Gree ME, Weaver AL, Dowdy SC, Podratz KC. The effect of diabetes and metformin on clinical outcomes is negligible in risk-adjusted endometrial cancer cohorts. Gynecol Oncol. 2016;140:270-276. [PubMed] [DOI] |
| 7. | Ma SJ, Zheng YX, Zhou PC, Xiao YN, Tan HZ. Metformin use improves survival of diabetic liver cancer patients: systematic review and meta-analysis. Oncotarget. 2016;7:66202-66211. [PubMed] [DOI] |
| 8. | Bao B, Azmi AS, Ali S, Zaiem F, Sarkar FH. Metformin may function as anti-cancer agent via targeting cancer stem cells: the potential biological significance of tumor-associated miRNAs in breast and pancreatic cancers. Ann Transl Med. 2014;2:59. [PubMed] [DOI] |
| 9. | Cai D, Sun H, Qi Y, Zhao X, Feng M, Wu X. Insulin-Like Growth Factor 1/Mammalian Target of Rapamycin and AMP-Activated Protein Kinase Signaling Involved in the Effects of Metformin in the Human Endometrial Cancer. Int J Gynecol Cancer. 2016;26:1667-1672. [PubMed] [DOI] |
| 10. | Ko JC, Chiu HC, Wo TY, Huang YJ, Tseng SC, Huang YC, Chen HJ, Syu JJ, Chen CY, Jian YT. Inhibition of p38 MAPK-dependent MutS homologue-2 (MSH2) expression by metformin enhances gefitinib-induced cytotoxicity in human squamous lung cancer cells. Lung Cancer. 2013;82:397-406. [PubMed] [DOI] |
| 11. | Ferroni P, Riondino S, Guadagni F, Roselli M. VEGF and VTE Risk in Cancer Patients--Letter. Clin Cancer Res. 2016;22:1295. [PubMed] [DOI] |
| 12. | Bayraktar S, Hernadez-Aya LF, Lei X, Meric-Bernstam F, Litton JK, Hsu L, Hortobagyi GN, Gonzalez-Angulo AM. Effect of metformin on survival outcomes in diabetic patients with triple receptor-negative breast cancer. Cancer. 2012;118:1202-1211. [PubMed] [DOI] |
| 13. | Jacob L, Kostev K, Rathmann W, Kalder M. Impact of metformin on metastases in patients with breast cancer and type 2 diabetes. J Diabetes Complications. 2016;30:1056-1059. [PubMed] [DOI] |
| 14. | Wan G, Yu X, Chen P, Wang X, Pan D, Wang X, Li L, Cai X, Cao F. Metformin therapy associated with survival benefit in lung cancer patients with diabetes. Oncotarget. 2016;7:35437-35445. [PubMed] [DOI] |
| 15. | Daugan M, Dufaÿ Wojcicki A, d'Hayer B, Boudy V. Metformin: An anti-diabetic drug to fight cancer. Pharmacol Res. 2016;113:675-685. [PubMed] [DOI] |
| 16. | Hankinson SJ, Fam M, Patel NN. A review for clinicians: Prostate cancer and the antineoplastic properties of metformin. Urol Oncol. 2017;35:21-29. [PubMed] [DOI] |
| 17. | Zou J, Hong L, Luo C, Li Z, Zhu Y, Huang T, Zhang Y, Yuan H, Hu Y, Wen T. Metformin inhibits estrogen-dependent endometrial cancer cell growth by activating the AMPK-FOXO1 signal pathway. Cancer Sci. 2016;107:1806-1817. [PubMed] [DOI] |
| 18. | De Souza A, Khawaja KI, Masud F, Saif MW. Metformin and pancreatic cancer: Is there a role? Cancer Chemother Pharmacol. 2016;77:235-242. [PubMed] [DOI] |
| 19. | Zhu J, Zheng Y, Zhang H, Sun H. Targeting cancer cell metabolism: The combination of metformin and 2-Deoxyglucose regulates apoptosis in ovarian cancer cells via p38 MAPK/JNK signaling pathway. Am J Transl Res. 2016;8:4812-4821. [PubMed] |
| 20. | Wink KC, Belderbos JS, Dieleman EM, Rossi M, Rasch CR, Damhuis RA, Houben RM, Troost EG. Improved progression free survival for patients with diabetes and locally advanced non-small cell lung cancer (NSCLC) using metformin during concurrent chemoradiotherapy. Radiother Oncol. 2016;118:453-459. [PubMed] [DOI] |
| 21. | Tseng CH. Metformin reduces gastric cancer risk in patients with type 2 diabetes mellitus. Aging (Albany NY). 2016;8:1636-1649. [PubMed] [DOI] |
| 22. | Seo YS, Kim YJ, Kim MS, Suh KS, Kim SB, Han CJ, Kim YJ, Jang WI, Kang SH, Tchoe HJ. Association of Metformin Use With Cancer-Specific Mortality in Hepatocellular Carcinoma After Curative Resection: A Nationwide Population-Based Study. Medicine (Baltimore). 2016;95:e3527. [PubMed] [DOI] |
| 23. | Cabello P, Pineda B, Tormo E, Lluch A, Eroles P. The Antitumor Effect of Metformin Is Mediated by miR-26a in Breast Cancer. Int J Mol Sci. 2016;17:pii E1298. [PubMed] [DOI] |
| 24. | Kobayashi M, Kato K, Iwama H, Fujihara S, Nishiyama N, Mimura S, Toyota Y, Nomura T, Nomura K, Tani J. Antitumor effect of metformin in esophageal cancer: in vitro study. Int J Oncol. 2013;42:517-524. [PubMed] [DOI] |
| 25. | Miyoshi H, Kato K, Iwama H, Maeda E, Sakamoto T, Fujita K, Toyota Y, Tani J, Nomura T, Mimura S. Effect of the anti-diabetic drug metformin in hepatocellular carcinoma in vitro and in vivo. Int J Oncol. 2014;45:322-332. [PubMed] [DOI] |
| 26. | Yang Y, Maimaitiyiming X, Jin C, Ahan N, Guo R, Peng C. Influence of Heparanase and VEGF-C mRNA Expressions in Lung Cancer. Indian J Surg. 2015;77:477-480. [PubMed] [DOI] |
| 27. | Zhao L, Zhang D, Ma H, Jin M, Huang F, Zhang T. High VEGF-A level at baseline predicts poor treatment effect of bevacizumab-based chemotherapy in metastatic colorectal cancer: a meta-analysis. Panminerva Med. 2016;58:48-58. [PubMed] |
| 28. | Wang J, Li G, Wang Y, Tang S, Sun X, Feng X, Li Y, Bao G, Li P, Mao X. Suppression of tumor angiogenesis by metformin treatment via a mechanism linked to targeting of HER2/HIF-1α/VEGF secretion axis. Oncotarget. 2015;6:44579-44592. [PubMed] [DOI] |
| 29. | Ersoy C, Kiyici S, Budak F, Oral B, Guclu M, Duran C, Selimoglu H, Erturk E, Tuncel E, Imamoglu S. The effect of metformin treatment on VEGF and PAI-1 levels in obese type 2 diabetic patients. Diabetes Res Clin Pract. 2008;81:56-60. [PubMed] [DOI] |
| 30. | Yi QY, Deng G, Chen N, Bai ZS, Yuan JS, Wu GH, Wang YW, Wu SJ. Metformin inhibits development of diabetic retinopathy through inducing alternative splicing of VEGF-A. Am J Transl Res. 2016;8:3947-3954. [PubMed] |
| 31. | Zhu M, Zhang Q, Wang X, Kang L, Yang Y, Liu Y, Yang L, Li J, Yang L, Liu J. Metformin potentiates anti-tumor effect of resveratrol on pancreatic cancer by down-regulation of VEGF-B signaling pathway. Oncotarget. 2016;7:84190-84200. [PubMed] |