修回日期: 2015-04-30
接受日期: 2015-05-19
在线出版日期: 2015-06-18
目的: 构建成纤维细胞生长因子4(fibroblast growth factor 4, FGF4)基因慢病毒过表达载体并对其进行鉴定、包装.
方法: 采用BamH Ⅰ/Age Ⅰ酶酶切含目的基因FGF4的质粒, 将目的基因与酶切线性化的载体进行定向交换, 构建重组慢病毒表达载体pGC-FU-FGF4, 将其产物转化大肠杆菌感受态细胞. 筛选阳性克隆先进行菌落PCR鉴定, 再对PCR鉴定阳性的克隆进行测序分析, 将目的质粒感染293T细胞24 h后, 采用Real-time定量PCR测定包装的病毒滴度.
结果: PCR结果显示扩增的目的基因FGF4已成功插入pGC-FU载体. 阳性克隆测序结果显示与目的基因序列一致. 目的质粒转染后24 h, 293T细胞几乎100%表达绿色荧光, Real-time定量PCR法测定包装的病毒滴度为2×108 TU/mL.
结论: 本实验成功构建了FGF4慢病毒表达载体, 成功对慢病毒及进行了包装及病毒滴度测定.
核心提示: 成纤维细胞生长因子4(fibroblast growth factor 4, FGF4)在间充质干细胞成肝脏样细胞的诱导中具有重要作用, 为明确FGF4因子的具体作用机制, 本研究拟建立稳定的FGF4基因慢病毒体系, 为其具体的机制研究奠定基础.
引文著录: 徐丽娟, 张云巍, 胡亚卓, 阎丽. FGF4基因慢病毒表达载体的构建、包装及鉴定. 世界华人消化杂志 2015; 23(17): 2768-2773
Revised: April 30, 2015
Accepted: May 19, 2015
Published online: June 18, 2015
AIM: To construct, package and identify a lentiviral vector carrying the fibroblast growth factor 4 gene (pGC-FU-FGF4).
METHODS: A plasmid containing the FGF4 gene was digested using BamH Ⅰ/Age Ⅰ restriction enzymes, and the target gene fragment was cloned into the pGC-FU vector to result in a recombinant lentiviral vector (pGC-FU-FGF4). pGC-FU-FGF4 was then transformed into competent Escherichia coli cells, and the positive clones were identified by PCR. The identified recombinant vector was used to infect 293T cells. The titer of packaged virus was determined using real-time quantitative PCR 24 h after infection.
RESULTS: PCR analysis showed that the amplified target gene was inserted in the pGC-FU vector. Digestion analysis showed that the reconstructed plasmid was consistent with the theoretical fragment, and the sequencing result showed that the positive fragment was exactly the same as the target gene. Twenty-four hours after infection, almost 100% of cells displayed green fluorescence. Real-time quantitative PCR assay showed that the packaged viral titer was 2×108 TU/mL.
CONCLUSION: A lentiviral vector carrying the FGF4 gene has been successfully constructed.
- Citation: Xu LJ, Zhang YW, Hu YZ, Yan L. Construction, packaging and identification of a lentiviral vector carrying the fibroblast growth factor 4 gene. Shijie Huaren Xiaohua Zazhi 2015; 23(17): 2768-2773
- URL: https://www.wjgnet.com/1009-3079/full/v23/i17/2768.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v23.i17.2768
肝硬化是绝大多数肝病发展的终末阶段, 由各种原因导致的急性或慢性肝功能衰竭及肝硬化严重威胁患者的生命, 肝移植是治疗终末期肝病的唯一有效治疗手段, 但由于供肝缺乏及免疫排斥等因素严重影响了其治疗的有效性. 人工生物肝是目前治疗肝硬化的一种新的治疗手段, 但建立有效的人工生物肝系统需要有效的种子细胞. 骨髓间充质干细胞(bone marrow mesenchymal stem cells BMSCs)通过直接分化、免疫活性抑制和/或旁分泌和等机制促进肝损伤后肝脏细胞的再生[1-3]. 然而, 他们作用于受损组织的机制, 定植机制及功能尚未明确[4,5]. 因此, 有效的治疗策略应着眼于提高体内或体外移植骨髓间充质干细胞定植和分化. 以往研究[6]显示成纤维细胞生长因子4(fibroblast growth factor 4, FGF4)在体外可促进骨髓间充质干细胞向肝脏样细胞分化, 这一结果表明, 移植的骨髓间充质干细胞向肝脏样细胞的分化可能是受损的肝细胞分泌的细胞因子来诱导的. 然而, 细胞因子促进肝脏细胞的修复机制仍不清楚. FGFs参与多种生物反应, 诸如细胞增殖、分化和迁移[7]. 在体外, FGF4代表的FGFs具有最高有丝分裂活性的几个细胞系[8-10]. 然而, 在体内, FGF4对肝细胞增殖和分化的影响的效果还不清楚. 因此, 在此研究中, 我们拟建立稳定的FGF4慢病毒转染体系, 为细胞治疗肝硬化的机制研究奠定基础.
pGC-FU Vector载体(GENECHEM公司); 1000 bp DNA ladder Marker(Fermentas公司); 250 bp DNA ladder Marker(捷瑞公司); 真核表达质粒载体pLenti6/V5-D-TOPO Vector; 慢病毒包装质粒pGC-LV、pHelper 1.0、pHelper 2.0(Invitrogen公司); 琼脂糖(赛百盛公司); Age Ⅰ(NEB公司); T4 DNA ligase(NEB公司); Taq polymerase(SinoBio); dNTP(Takara); Primer(捷瑞生物); Plasmid抽提Kit(Promega); 大肠杆菌菌株DH5α.
1.2.1 慢病毒载体酶切: 使用BamH Ⅰ/Age Ⅰ进行酶切消化: 取ddH2O 41 µL, 10×Buffer 5 µL, 纯化的DNA质粒(1 µg/µL)2 µL, BamH Ⅰ(20 U/µL) 1 µL, Age Ⅰ(5 U/µL) 1 µL, 总体积50 µL, 构成酶切反应体系. 将上述混合的反应物置于37 ℃, 2 h. 电泳回收酶切片段.
1.2.2 目的基因片段的获取与扩增: (1)引物合成: 引物: Ubi-F: 5'-GGGTCAATATGTAATTTTCAGTG-3', 该引物位于Ubiquitin启动子中, 用于测序; 引物EGFP-N-R: 5'-CGTCGCCGTCCAGCTCGACCAG-3', 该引物位于增强绿色荧光蛋白(enhanced green fluorescent protein, EGFP)基因的N端, 用于菌落PCR鉴定转化子以及测序. 将目的基因FGF4与pLenti6/V5-D-TOPO Vector相连接, 构成目的基因质粒, 转化入大肠杆菌, 抽提FGF4-pLenti6/V5质粒(方法参照试剂盒说明书); (2)BamH Ⅰ/Age Ⅰ酶切化学合成的含有目的基因的质粒: 使用BamH Ⅰ/Age Ⅰ进行酶切消化: 取ddH2O 41 µL, 10×Buffer 5 µL, 纯化的DNA质粒(1 µg/µL)2 µL, BamH Ⅰ(20 U/µL) 1 µL, Age Ⅰ(5 U/µL) 1 µL, 总体积50 µL, 构成酶切反应体系. 将上述混合的反应物置于37 ℃, 2 h. 电泳回收酶切片段: 594 bp.
1.2.3 重组克隆制备: (1)感受态制备: 用氯化钙制备新鲜的大肠杆菌感受态细胞: 从于37 ℃培养16 h的新鲜平板中挑取一个单菌落, 转到一个含有100 mL LB培养基(Luria-Bertani培养基)的1 L烧瓶中. 于37 ℃剧烈振摇培养3 h(旋转摇床, 300 r/min). 在无菌条件下将细菌转移到一个无菌、一次性使用的、用冰预冷的50 mL聚丙烯管中, 在冰上放置10 min, 使培养物冷却至0 ℃. 于4 ℃、4000 r/min离心10 min, 回收细胞. 倒出培养液, 将管倒置1 min, 使最后残留的痕量培养液流尽. 以10 mL用冰预冷的0.1 mol/L CaCl2重悬每份沉淀, 放置于冰浴上. 于4 ℃, 以4000 r/min离心10 min, 回收细胞. 倒出培养液, 将管倒置1 min, 使最后残留的痕量培养液流尽. 每50 mL初始培养物用2 mL用冰预冷的0.1 mol/L CaCl2重悬每份细胞沉淀. 将细胞分装成小份, 加入DMSO, 置于-70 ℃冻存; (2)酶切获得的目的基因连接入线性化慢病毒载体; (3)建立以下反应体系: 阳性对照组: 加入10×T4 Buffer 2 µL, 50% PEG4000 2 µL, 酶切载体DNA 5 µL, 酶切纯化的PCR产物10 µL, T4 DNA Ligase 1 µL, 总体积20 µL; 自连对照组: 加入ddH2O 10 µL, 10×T4 Buffer 2 µL, 50% PEG4000 2 µL, 酶切载体DNA 5 µL, T4 DNA Ligase 1 µL, 总体积20 µL; 连接组: 10×T4 Buffer 2 µL, 50% PEG4000 2 µL, 酶切载体DNA 5 µL, 酶切纯化的PCR产物10 µL, T4 DNA Ligase 1 µL, 总体积20 µL; 于22 ℃连接3 h后转化.
1.2.4 细胞转染: 用冷却的无菌吸头从每种感受态细胞悬液中各取200 µL转移到无菌的微量离心管中, 每管加10 µL连接液, 轻轻旋转以混匀内容物, 在冰中放置30 min. 将管放到预加温到42 ℃的循环水浴中放好的EP管架上, 恰恰放置90 s, 不要摇动EP管架. 快速将管转移到冰浴中, 使细胞冷却1-2 min. 每管加800 µL LB培养基. 用水浴将培养基加温至37 ℃, 然后将管转移到37 ℃摇床上, 温育45 min使细菌复苏. 将150 µL已转化的感受态细胞转移到氨苄青霉素(ampicillin, AMP)抗性(100 µg/mL)的LB琼脂培养基上. 将平板置于室温直至液体被吸收. 倒置平皿, 于37 ℃培养, 16 h. 长出的克隆进行后续PCR鉴定.
1.2.5 阳性克隆的PCR鉴定: 用PCR扩增的方法鉴定阳性克隆, 建立PCR反应体系, PCR反应条件: 94 ℃预变性2 min, 94 ℃变性30 s, 60 ℃复性30 s, 72 ℃延伸40 s, 扩增30个循环, 最后72 ℃延伸6 min, 4 ℃冷却. 电泳鉴定PCR产物. 接种阳性转化子, 37 ℃培养16 h后保存为甘油菌, 分装200 µL送测序.
1.2.6 慢病毒颗粒的包装和滴度测定: 制备编码慢病毒颗粒的重组病毒质粒及其两种辅助包装原件载体质粒, 3种质粒载体分别进行高纯度无内毒素抽提, 按Invitrogen公司Lipofectamine 2000使用说明进行共转染293T细胞, 转染后8 h更换为完全培养基, 培养48 h 后, 收集富含慢病毒颗粒的细胞上清液, 对其浓缩后得到高滴度的慢病毒浓缩液, 在293T细胞中测定并标定病毒滴度.
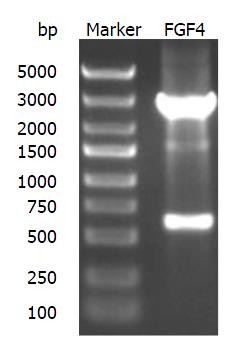
以含有FGF4基因的质粒为模板, 采用特异引物, 扩增FGF4基因片段, 产物长度为594 bp, 电泳可见特异条带, 与预期目标一致, 结果如图1.
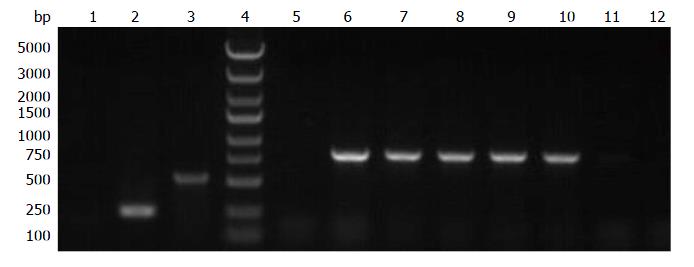
将阳性克隆进行PCR鉴定, 1通道为阴性对照组, 使用水作为模板, 排除系统中外源核酸污染导致假阳性结果; 2通道为空载自连自连对照, 使用自连对照转化子为模板, 排除非特异性扩增导致的导致假阳性结果; 3通道为阳性对照: 使用阳性对照转化子为模板, 扩增GAPDH基因的一部分, 用来排除PCR试剂、PCR仪器以及PCR反应条件等原因导致的假阴性结果. 5-12号为实验组样品. 阳性对照组和实验组均有较明显的印迹, 说明感染慢病毒颗粒印迹较强, 构建表达FGF4基因的慢病毒载体可高效表达FGF4蛋白. 空载自连对照的到245 bp条带, 阳性克隆得到831 bp条带, 与预期一致, 如图2.
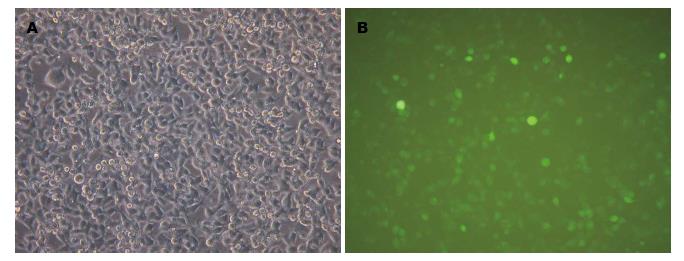
目的质粒转染后24 h, 293T细胞荧光阳性表达几乎达100%, 结果如图3.
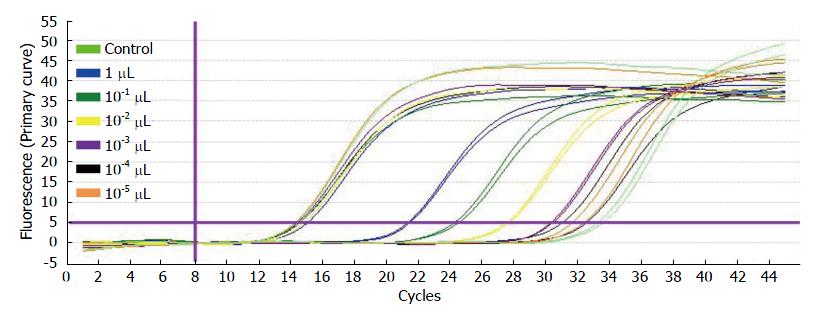
采用Real-time定量PCR 法测定包装的病毒滴度, 病毒包装滴度为: 2×108TU/mL, 如表1、图4.
| 样品组 | Ct内参 | Ct靶基因 | Ct靶基因均值 | △Ct = Ct靶基因均值- Ct内参 | △CtCON-△Ct样品组 |
| Control组 | 14.45 | 33.87 | 34.020 | 19.570 | 0.000 |
| 34.17 | |||||
| 1.00 μL | 14.89 | 21.21 | 21.150 | 6.260 | 13.310 |
| 21.09 | |||||
| 1.00×10-1 μL | 14.26 | 24.52 | 24.610 | 10.350 | 9.220 |
| 24.70 | |||||
| 1.00×10-2 μL | 14.61 | 27.72 | 27.705 | 13.095 | 6.475 |
| 27.69 | |||||
| 1.00×10-3 μL | 14.40 | 30.13 | 30.280 | 15.880 | 3.690 |
| 30.43 | |||||
| 1.00×10-4 μL | 14.37 | 31.40 | 31.965 | 17.595 | 1.975 |
| 32.53 | |||||
| 1.00×10-5 μL | 14.39 | 32.90 | 32.325 | 17.935 | 1.635 |
| 31.75 |
在本研究中, 我们成功利用慢病毒表达系统克隆了大鼠FGF4的cDNA的编码区序列, 并通过酶切鉴定、PCR鉴定、DNA序列分析鉴定证实了其正确性. FGFs是一组结构相近, 在多种生理过程如增殖、分化、血管生成、转化及细胞生长具有重要作用的生长因子. FGF4作为的FGFs中的一个重要组成因子, 在许多不同类型的细胞和组织中细胞增殖, 迁移, 存活及分化起重要作用. 此外FGF4表达于多种肿瘤组织, 如乳腺癌[11]、卡西波肉瘤(Kaposi's sarcoma)[12]等. Koh等[13]发现FGF4能提高急性白血病患者骨髓基质细胞的产量, Schwartz等[14]发现FGF4在内皮特化方面起重要作用. 鉴于FGF4因子在诱导肝脏样细胞的重要作用, 我们建立了稳定的慢病毒表达体系.
常用的病毒性载体包括腺相关病毒载体、慢病毒载体、逆转录病毒载体、腺病毒载体、痘苗病毒载体、单纯疱疹病毒载体等. 慢病毒载体是以人类免疫缺陷1型病毒为基础发展起来的基因治疗载体, 慢病毒载体具有独特的优越性, 其转染效率高, 可以有效转导分裂和非分裂细胞, 慢病毒载体整合进入宿主细胞基因组中, 能稳定的表达转基因和维持转基因的种系传递, 并且转导的细胞能保留自我复制和亚全能性的性能, 因此被广泛应用于基因功能研究和基因治疗领域[15,16].
鉴于FGF4基因在间充质干细胞向肝脏样细胞分化的重要作用以及科研和临床都急需建立高效稳定安全的FGF4慢病毒载体, 因此, 我们探索了一种FGF4慢病毒载体的构建方法, 而且鉴定结果也表明pGC-FU-FGF4慢病毒载体成功构建, 为下一步针对FGF4基因的体外实验提供了可行性.
肝移植是治疗肝硬化唯一有效的治疗手段, 但由于供肝缺乏及免疫排斥等原因, 严重限制了其中治疗的有效性, 研究显示成纤维细胞生长因子4(fibroblast growth factor 4, FGF4)在体外可促进骨髓间充质干细胞向肝脏样细胞分化, 因此本研究拟建立FGF4基因慢病温度载体, 为明确FGF4促进肝脏样细胞再生的机制研究奠定基础.
刘绍能, 主任医师, 中国中医科学院广安门医院消化科
目前关于FGF4基因促进间充质干细胞向肝脏样细胞转化的机制研究较少, 关于FGF4基因慢病毒载体建立的研究也较少, 本研究拟建立一种稳定的FGF4基因慢病体系, 为FGF4基因促进间充质干细胞向肝脏样细胞转化的机制研究奠定基础.
Farré等阐述了FGF4因子具有促进人骨髓间充质细胞生长的作用, 并且不会改变细胞的表型及多向分化潜能.
为建立稳定的重组慢病毒表达载体pGC-FU-FGF4提供一种可行的方法, 为FGF4在间充质干细胞成肝脏样细胞的诱导中具体作用的机制研究奠定了基础.
慢病毒载体: 慢病毒载体是以人类免疫缺陷1型病毒为基础发展起来的基因治疗载体, 其转染效率高, 可以有效转导分裂和非分裂细胞, 因此被广泛应用于基因功能研究和基因治疗领域; FGF4基因: FGFs家族的一员, 在体外, FGF4代表的FGFs具有最高有丝分裂活性的几个细胞系; 感受态细胞: 通过理化诱导, 使细胞处于最适摄取和容纳外来DNA的生理状态的细胞称为感受态细胞.
构建了重组慢病毒表达载体pGC-FU-FGF4, 并将其产物转化大肠杆菌感受态细胞, 采用Real-time定量PCR测定包装的病毒滴度. 结果显示扩增的目的基因FGF4已成功插入pGC-FU载体, 并且得到的蛋白片段与目的蛋白大小相符, 与目的基因序列一致. 本研究实验设计合理, 资料详细, 结果可信, 有一定的参考价值.
编辑:郭鹏 电编:都珍珍
| 1. | Fouraschen SM, Pan Q, de Ruiter PE, Farid WR, Kazemier G, Kwekkeboom J, Ijzermans JN, Metselaar HJ, Tilanus HW, de Jonge J. Secreted factors of human liver-derived mesenchymal stem cells promote liver regeneration early after partial hepatectomy. Stem Cells Dev. 2012;21:2410-2419. [PubMed] [DOI] |
| 2. | Stock P, Brückner S, Ebensing S, Hempel M, Dollinger MM, Christ B. The generation of hepatocytes from mesenchymal stem cells and engraftment into murine liver. Nat Protoc. 2010;5:617-627. [PubMed] [DOI] |
| 3. | Li J, Zhang L, Xin J, Jiang L, Li J, Zhang T, Jin L, Li J, Zhou P, Hao S. Immediate intraportal transplantation of human bone marrow mesenchymal stem cells prevents death from fulminant hepatic failure in pigs. Hepatology. 2012;56:1044-1052. [PubMed] [DOI] |
| 4. | Puglisi MA, Tesori V, Lattanzi W, Piscaglia AC, Gasbarrini GB, D'Ugo DM, Gasbarrini A. Therapeutic implications of mesenchymal stem cells in liver injury. J Biomed Biotechnol. 2011;2011:860578. [PubMed] [DOI] |
| 5. | Yuan S, Jiang T, Sun L, Zheng R, Ahat N, Zhang Y. The role of bone marrow mesenchymal stem cells in the treatment of acute liver failure. Biomed Res Int. 2013;2013:251846. [PubMed] [DOI] |
| 6. | Yan L, Han Y, Wang J, Liu J, Hong L, Fan D. Peripheral blood monocytes from patients with HBV related decompensated liver cirrhosis can differentiate into functional hepatocytes. Am J Hematol. 2007;82:949-954. [PubMed] |
| 7. | Coumoul X, Deng CX. Roles of FGF receptors in mammalian development and congenital diseases. Birth Defects Res C Embryo Today. 2003;69:286-304. [PubMed] |
| 8. | Ornitz DM, Xu J, Colvin JS, McEwen DG, MacArthur CA, Coulier F, Gao G, Goldfarb M. Receptor specificity of the fibroblast growth factor family. J Biol Chem. 1996;271:15292-15297. [PubMed] |
| 9. | Farré J, Roura S, Prat-Vidal C, Soler-Botija C, Llach A, Molina CE, Hove-Madsen L, Cairó JJ, Gòdia F, Bragós R. FGF-4 increases in vitro expansion rate of human adult bone marrow-derived mesenchymal stem cells. Growth Factors. 2007;25:71-76. [PubMed] |
| 10. | Choi SC, Kim SJ, Choi JH, Park CY, Shim WJ, Lim DS. Fibroblast growth factor-2 and -4 promote the proliferation of bone marrow mesenchymal stem cells by the activation of the PI3K-Akt and ERK1/2 signaling pathways. Stem Cells Dev. 2008;17:725-736. [PubMed] [DOI] |
| 11. | Penault-Llorca F, Bertucci F, Adélaïde J, Parc P, Coulier F, Jacquemier J, Birnbaum D, deLapeyrière O. Expression of FGF and FGF receptor genes in human breast cancer. Int J Cancer. 1995;61:170-176. [PubMed] |
| 12. | Kiuru-Kuhlefelt S, Sarlomo-Rikala M, Larramendy ML, Söderlund M, Hedman K, Miettinen M, Knuutila S. FGF4 and INT2 oncogenes are amplified and expressed in Kaposi's sarcoma. Mod Pathol. 2000;13:433-437. [PubMed] |
| 13. | Koh KR, Ohta K, Nakamae H, Hino M, Yamane T, Takubo T, Tatsumi N. Differential effects of fibroblast growth factor-4, epidermal growth factor and transforming growth factor-beta1 on functional development of stromal layers in acute myeloid leukemia. Leuk Res. 2002;26:933-938. [PubMed] |
| 14. | Schwartz RE, Reyes M, Koodie L, Jiang Y, Blackstad M, Lund T, Lenvik T, Johnson S, Hu WS, Verfaillie CM. Multipotent adult progenitor cells from bone marrow differentiate into functional hepatocyte-like cells. J Clin Invest. 2002;109:1291-1302. [PubMed] |
| 15. | Escors D, Breckpot K. Lentiviral vectors in gene therapy: their current status and future potential. Arch Immunol Ther Exp (Warsz). 2010;58:107-119. [PubMed] [DOI] |