修回日期: 2014-06-25
接受日期: 2014-07-01
在线出版日期: 2014-08-18
目的: 探讨滤泡辅助T细胞(follicular helper T cell, Tfh)在免疫复合物联合三硝基苯磺酸(trinitrobenzene sulfonic acid, TNBS)诱导的小鼠结肠炎发病中的变化.
方法: 12只♂BALB/c小鼠(6-8周龄)随机分为2组: 模型组与对照组各6只. 模型组分别于第0、7、14、21天给予免疫复合物皮下及腹腔注射, 第28天给予TNBS灌肠诱导结肠炎模型; 对照组同时间给予等量生理盐水注射及50%乙醇灌肠. 每日记录小鼠体质量变化, 于第42天处死小鼠, 结肠组织HE染色评价肠道炎症; 测定结肠组织髓过氧化物酶(myeloperoxidase, MPO)活力; 分离脾脏淋巴细胞, 测定Tfh细胞及浆细胞的比例; 测定外周血清IgG含量; 实时荧光定量PCR检测肠道组织Bcl-6及白介素-21(interleukin-21, IL-21) mRNA的表达.
结果: 成功构建结肠炎小鼠模型, 模型组小鼠肠道MPO活力较对照组明显升高(P<0.05); 模型组小鼠脾脏Tfh细胞数量和浆细胞数量分别为1.550%±0.414%和0.780%±0.360%, 较对照组(1.000%±0.108%, 0.300%±0.063%)都明显升高(P<0.05); 模型组外周血清IgG含量较对照组升高(P<0.05); 模型组肠道组织Bcl-6和IL-21 mRNA的表达上调, 分别是对照组表达量(1.00±0.00)的3.87倍和18.40倍, 差异具有统计学意义.
结论: Tfh细胞在免疫复合物联合TNBS诱导的结肠炎小鼠体内显著上调, 他在结肠炎发病中可能发挥着重要作用.
核心提示: 本研究显示, 滤泡辅助T细胞(follicular helper T cell, Tfh)和血清中IgG含量在免疫复合物联合三硝基苯磺酸诱导的结肠炎小鼠体内显著上调, 在RNA水平上, 肠道组织中Bcl-6和白介素-21 mRNA的表达都明显上调, 与细胞水平的结果是一致的, 说明Tfh在结肠炎发病中可能发挥着重要作用.
引文著录: 杨建美, 付妤, 邹开芳, 刘晓晶, 门路. 滤泡辅助T细胞在免疫复合物联合三硝基苯磺酸诱导的小鼠结肠炎发病中的变化. 世界华人消化杂志 2014; 22(23): 3452-3458
Revised: June 25, 2014
Accepted: July 1, 2014
Published online: August 18, 2014
AIM: To investigate the changes in follicular helper T (Tfh) cells in immune complex and TNBS induced colitis in mice.
METHODS: Twelve male BALB/c mice were randomly divided into two groups: a control group and a model group. The model group was given subcutaneous and intraperitoneal injection of immune complex on days 0, 7, 14 and 21, and intracolonic administration of TNBS in 50% ethanol on day 28. The control group was treated with equal volumes of saline and 50% ethanol at the same time. All of the mice were sacrificed on day 42, and the colonic inflammation was assessed by HE staining and MPO activity assay. Changes in the numbers of Tfh and plasma cells were detected by flow cytometry. The expression of interleukin-21 (IL-21) and Bcl-6 mRNAs in the colon mucosa was determined by RT-PCR. ELISA was used to detect the titers of serum autoantibodies.
RESULTS: MPO activity in the model group (0.4543 U/g ± 0.12207 U/g) was significantly increased compared with the control group (0.3127 U/g ± 0.06983 U/g, P < 0.05). The percentages of Tfh and plasma cells were 1.550% ± 0.414% and 0.780% ± 0.360% in the model group, which were significantly higher than those in the control group (1.000% ± 0.108%, 0.300% ± 0.063%, P < 0.05). Serum IgG level was significantly higher in the model group than in the control group (372.3 ng/mL ± 43.925 ng/mL vs 7.94 ng/mL ± 26.356 ng/mL, P < 0.05). The expression of Bcl-6 and IL-21 mRNAs in the colon mucosa in the model group was 3.87 and 18.4 times higher than that in the control group, respectively.
CONCLUSION: Tfh cells may play an important role in the pathogenesis of colitis.
- Citation: Yang JM, Fu Y, Zou KF, Liu XJ, Men L. Changes in follicular helper T cells in immune complex and TNBS induced colitis in mice. Shijie Huaren Xiaohua Zazhi 2014; 22(23): 3452-3458
- URL: https://www.wjgnet.com/1009-3079/full/v22/i23/3452.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v22.i23.3452
溃疡性结肠炎(ulcerative colitis, UC)的发病率逐年升高[1-3], 肠道炎症发生发展的具体机制目前尚不完全清楚, 但自身免疫因素在其发病中的作用已得到广泛认可. 滤泡辅助T细胞(follicular helper T cell, Tfh)是新发现的一类辅助性T细胞[4], 他定位在淋巴滤泡, 辅助B细胞产生抗体[5], 是参与体液免疫的重要成分, 他在抗体类别转换中发挥着关键作用[6], 能使自身抗体对机体产生持续的免疫损伤. 研究发现, 在系统性红斑狼疮患者外周血中存在Tfh细胞异常, 并与自身抗体形成及病情严重程度有相关性[7]. 无独有偶, 在对关节炎患者的研究中也有类似的发现, Tfh细胞数量增加, 生发中心形成增加[8]. 白介素-21(interleukin-21, IL-21)是Tfh细胞的主要效应因子, 有研究发现UC患者直肠黏膜IL-21表达增加[9]. 我们猜想, UC作为自身免疫性疾病, 可能也存在Tfh细胞异常及自身抗体形成的增加. 本文利用免疫复合物联合TNBS建立小鼠结肠炎模型, 通过检测Tfh细胞及其相关指标来探讨Tfh细胞在小鼠结肠炎发病中的变化.
12只♂BALB/c小鼠, 6-8周龄, 购自武汉大学实验动物中心[许可证号: SCXK(鄂)2008-0004], 饲养于华中科技大学实验动物中心[许可证号: SYXK(鄂)2010-0057]. 提取结肠抗原的大耳白兔购自华中科技大学同济医学院实验动物中心. TNBS、弗氏完全佐剂(freunds adjuvant complete)购自Sigma公司; BCA试剂盒购自北京普利莱基因技术有限公司; 过氧化物酶(myeloperoxidase, MPO)试剂盒购自南京建成科技有限公司; 淋巴细胞分离液购自美国Mediatech公司; 流式抗体购自Biolegend公司、eBioscience公司和美国BD公司; 小鼠IgG ELISA试剂盒购自欣博盛生物科技公司; M-MLV逆转录酶, TRIzol均购自Invitrogen公司; 离子霉素购自美国cayman公司; 佛波酯购自Biomol公司; 布雷菲德菌素A购自美国Enzo公司. PCR引物由Invitrogen公司合成. 流式细胞仪为BD公司, LSRⅡ. DNA/RNA浓度测定仪为法玛西亚公司生产; 实时荧光定量PCR仪ABI StepOne™由美国Applied Biosystems公司生产.
1.2.1 抗原乳化剂的制备: 参照文献[10]将大耳白兔用1%戊巴比妥钠腹腔麻醉(30 mg/kg), 剖取兔结肠组织, 无菌PBS冲洗干净后用玻璃匀浆器制成匀浆, -80 ℃下冷冻24 h, 冻融后以4000 r/min速度低温离心30 min, 取上清液用BCA试剂盒测其黏膜蛋白含量, 浓度约7.0 μg/μL. 使用时加入等量freund完全佐剂制成抗原乳化剂.
1.2.2 动物分组及处理: BALB/c小鼠随机分为两组: 模型组与对照组. 模型组于第0、7、14和 21天连续给予4次抗原乳化剂注射, 第28天给予三硝基苯磺酸50%乙醇100 mg/kg灌肠. 对照组在第0、7、14和21天给予等体积生理盐水注射, 第28天给予等体积500 mL/L乙醇灌肠. 第42天断颈处死所有小鼠.
1.2.3 小鼠一般情况观察、组织学改变、DAI及MPO的计算: 每日记录小鼠的精神、体质量及大便情况, 于第42天参照文献[11]按表1计算疾病活动指数(disease activity index, DAI)以评价疾病活动度. 处死小鼠后选取结肠病变严重处进行苏木素-伊红(HE)染色, 显微镜下观察病变. 研磨结肠组织, 按说明书测定髓过氧化物酶活力.
| 记分 | 体质量下降(%) | 大便性状 | 便血 |
| 0 | 无 | 正常 | 隐血(-) |
| 1 | 1-5 | ||
| 2 | 6-10 | 松散 | 隐血(+) |
| 3 | 11-15 | ||
| 4 | >15 | 稀便 | 肉眼血便 |
1.2.4 脾脏单个核细胞提取: 完整剥离脾脏, 用无菌生理盐水冲洗干净后置于预先准备的200目滤布上, 用注射器针芯充分研磨, 同时用1640培养基冲洗制备细胞悬液. 用淋巴细胞分离液密度梯度离心后收集单个核细胞.
1.2.5 浆细胞数量检测: 单个核细胞浓度调整至100 μL×106, 参照文献[12]用FITC抗小鼠CD93和PE抗小鼠CD138标记浆细胞, 4 ℃孵育30 min后洗涤2次, 流式细胞仪检测浆细胞数量.
1.2.6 Tfh细胞数量检测: 单个核细胞浓度调整至100 μL×106, 在含脾脏单个核细胞的培养基中加入终浓度为50 ng/mL的佛波酯、750 ng/mL的离子霉素和1×的布雷菲德菌素A, 37 ℃ CO2孵育箱中孵育4 h. FITC抗小鼠CD4、PE-Cy7抗小鼠CXCR5和APC抗小鼠CD278抗体进行细胞表面标记, 经固定破膜后用PE抗小鼠Bcl-6抗体进行核内转录因子标记. 四色流式检测Tfh细胞的比例, 使用美国LSRⅡ(BD公司)流式细胞仪, 同时表达CD4、CXCR5、CD278(ICOS)和Bcl-6的细胞为Tfh细胞.
1.2.7 IgG含量测定: 心脏取血, 4000 r/min离心收集血清, 检测血清IgG含量(按试剂盒说明书操作).
1.2.8 结肠黏膜IL-21及Bcl-6 mRNA检测: 称取100 mg结肠组织, 置于1 mL TRIzol溶液中充分匀浆, 按TRIzol说明书提取结肠黏膜总RNA. 分光光度计检测RNA浓度和纯度后, 按M-MLV逆转录酶说明书逆转录获得cDNA, 实时荧光定量PCR检测IL-21及Bcl-6 mRNA的表达. 引物序列如表2. PCR反应采用10 μL体系, 包括上下游引物各0.5 μL(10 μmol/L), SYBR Green 5 μL, cDNA 1 μL, ddH2O 3 μL. PCR反应条件: 95 ℃ 10 min; 95 ℃ 15 s; 60 ℃ 1 min, 40个循环. 荧光实时定量PCR的数据结果参照文献[13]采用2-∆∆CT分析.
| 引物名称 | 序列 |
| β-actin | F: 5'-CGTGCGTGACATCAAAGAGAA-3' |
| R: 5'-GGCCATCTCCTGCTCGAA-3' | |
| Bcl-6 | F: 5'-GCACTGGGCAAACACAACAT-3' |
| R: 5'-AGCGTGCCGGGTAAACTG-3' | |
| 白介素-21 | F: 5'-GCAGCACAGGCTAAGAGCTTGTA-3' |
| R: 5'-TGGCTAGTGGAGAAGCCTTCA-3' |
统计学处理 采用SPSS17.0软件, 所有数据均采用mean±SD表示, 组间比较行两个样本t检验. P<0.05为差异有统计学意义.
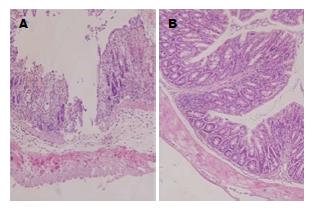
模型组小鼠从第0天注射抗原乳化剂后, 注射处皮肤开始出现皮疹, 甚至溃烂. 随着时间推移, 皮疹及溃烂处开始愈合, 小鼠活动及精神、进食无明显改变. TNBS灌肠后1-5 d内小鼠活动减少, 进食饮水减少, 体质量每日减轻约0.2-0.5 g, 可见血便及黏液便. 于灌肠后5-7 d, 上述症状逐渐好转. 结肠HE染色后在显微镜下放大200倍可见腺体结构紊乱, 黏膜连续性中断形成糜烂甚至溃疡, 且黏膜上皮及固有层内有大量炎细胞浸润, 并可见红细胞. 对照组无上述改变(图1).
造模后2 wk DAI较对照组显著增高, 结肠组织MPO活力较对照组也显著升高(表3).
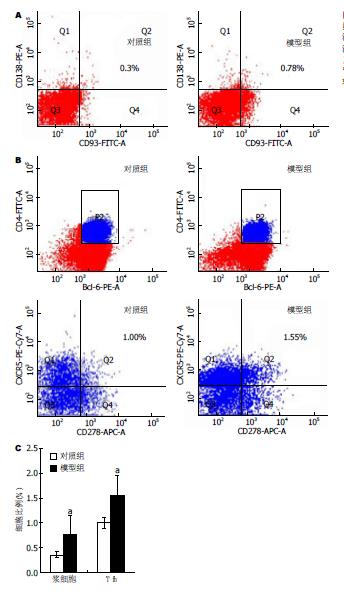
模型组小鼠脾脏Tfh细胞比例为1.550%±0.414%, 浆细胞比例为0.780%±0.360%. 较对照组Tfh细胞比例(t = -3.138, P = 0.022)和浆细胞比例(t = -3.238, P = 0.021)都明显上调, 差异有统计学意义(图2).
对照组小鼠血清IgG含量为7.941 ng/mL±26.356 ng/mL, 模型组IgG含量为372.3 ng/mL±43.925 ng/mL, 较对照组显著升高(t = -14.076, P = 0.000).
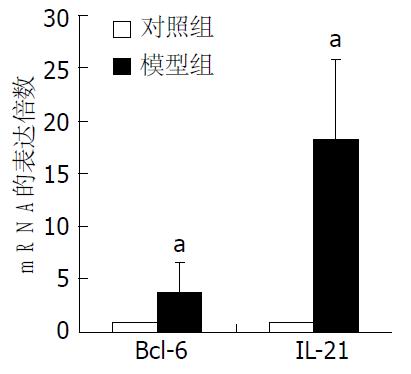
以对照组mRNA的表达量作为参照, 模型组IL-21 mRNA表达量(18.40±7.52)是对照组的18.40倍(t = -5.665, P = 0.002), Bcl-6 mRNA的表达量是对照组的3.87倍(t = -2.766, P = 0.040), 差异均具有统计学意义(图3).
目前对于UC发病机制的研究主要涉及4个方面: 遗传背景、环境因素、社会因素及自身免疫紊乱[14], 免疫因素研究较为广泛. UC的自身免疫反应包括细胞免疫和体液免疫. 在UC细胞免疫研究方面, 目前已取得一定进展. CD4+ T细胞是自身免疫性疾病的主要免疫细胞. 初始CD4+ T细胞在不同抗原刺激下诱导分化为不同功能的效应T细胞, 如Th1、Th2、Th17、Treg及Tfh细胞等[15]. 已经有临床研究证实, 在UC患者外周血及结肠黏膜单个核细胞中Th1及Th2细胞无显著变化. 而Th17细胞在UC患者肠道中数目及效应因子表达增加[16]. 调节性T细胞(regulatory T cell, Treg细胞)特异性转录因子FOXP3的表达却明显下调[17]. 在体液免疫方面, 目前研究尚无突破性进展. 近年来已经有研究发现有多种自身抗体参与了UC的发病, 如抗结肠源性上皮细胞抗体、抗中性粒细胞胞浆抗体、抗细胞核成分抗体以及抗肠道菌群的抗体等[18], 临床研究表明UC患者血清中自身抗体不仅滴度增加, 而且与病情及治疗相关[19]. 越来越多的证据都提示我们, 在UC的发病中既有细胞免疫异常, 同时也存在体液免疫异常.
动物模型的建立对UC发病机制的研究尤为重要, 传统的方法包括基因敲除型、转基因型、化学诱导模型和组织或细胞移植诱导模型等[20-23]. 我们的前期研究证实, 免疫复合物联合TNBS建立的动物模型与单纯TNBS灌肠和单纯免疫复合物注射的大鼠比较, 体内发生了更显著的免疫紊乱, 他所诱导的结肠炎会产生更强更持久的反应, 并且引起了Th1和Th2细胞共同的变化, 该模型更符合T细胞与B细胞共同作用的所致的IBD的要求[24]. 因此, 在本文中我们继续选择此种方法, 稍做修改建立结肠炎动物模型.
自从Tfh细胞的发现以来, 大量研究表明Bcl-6被认为是控制初始T细胞分化为Tfh的转录因子. Tfh表面表达的受体CXCR5是Tfh迁移、定位重要的"转运分子", 也是Tfh细胞的表面标志. Tfh表面表达的CD40Lhi和ICOShi分别通过与B细胞上CD40和ICOSL结合以提供共刺激信号, 同时Tfh还分泌IL-21, 促进浆细胞形成、抗体类型转换及生发中心寿命延长[6]. 由此可见, Tfh细胞在自身抗体形成, 对机体产生持续免疫损伤的过程中扮演着不可替代的作用. 近年来的研究表明, CD93可以作为成熟的抗体分泌细胞的表面标志[12]. CD138(又名syndecan-1)是一种细胞表面受体, 他的主要功能是参与细胞-细胞与细胞-基质黏附[25,26]. 在血液系统, CD138只表达在正常与恶变的浆细胞表面[27-29], CD138可以作为浆细胞的表面标志[30]. 研究中发现, 小鼠模型CD93和CD138双阳性细胞数目增多且血清中IgG含量显著升高. 可见, 在结肠炎小鼠体内发生了明显的体液免疫效应, 在淋巴滤泡生发中心, B细胞与Tfh细胞相互作用, B细胞分化出大量的长效浆细胞, 从而生成了大量自身抗体, 促使疾病的发生. 在RNA水平上, 肠道组织中Bcl-6和IL-21 mRNA的表达都明显上调, 与细胞水平的结果是一致的. 种种证据都提示我们, Tfh细胞在结肠炎小鼠中呈现出上调的趋势, 并在自身抗体形成的过程中发挥着十分重要的作用.
有科学家发现了在系统性红斑狼疮患者外周血中存在Tfh细胞异常, 并与自身抗体形成及病情严重程度有相关性[7]. 因此可以试想, 在Tfh调节自身抗体形成的环节给予适当干预或许能够获得理想的治疗效果. 已经有研究发现, 减少狼疮动物模型的Tfh细胞和浆细胞可以缓解狼疮症状[31]; 而过继Tfh细胞却可使狼疮症状加重[32]. 我们的检测结果显示Tfh细胞数量及相关因子表达在小鼠实验性结肠炎中有改变, 说明Tfh细胞参与了小鼠结肠炎的发病, 作为Tfh这个新发现的细胞亚群, 其在IBD中的作用是以往研究未曾探讨过的问题, 因此本研究为今后的进一步研究提供了方向. 但这种改变是原因还是结果尚不能做出结论, 我们通过参考Tfh在其他自身免疫性疾病中的作用推测Tfh可能起到引发炎症的作用, 这也需要我们在进一步的实验中, 比如过继转移Tfh细胞或干扰Tfh细胞的作用来证明他是否是引起肠道炎症的原因.
滤泡辅助T滤泡辅助T细胞(folli-cular helper T cell, Tfh)是参与体液免疫的重要成分, 他在抗体类别转换中发挥着关键作用, 能使自身抗体对机体产生持续的免疫损伤. 其在自身免疫性疾病发病中的作用越来越受到研究者们的重视. 他在炎症性肠病发病中的作用缺少相关研究.
黄缘, 教授, 南昌大学第二附属医院消化内科, 江西省分子医学重点实验室.
目前炎症性肠病的发病机制的研究主要集中在细胞免疫方面, 本文重点研究Tfh在小鼠结肠炎发病中的变化, 探讨Tfh在结肠炎发病中可能发挥的作用, 希望在体液免疫方面有所突破.
近年来已经有研究发现有多种自身抗体参与了溃疡性结肠炎(ulcer-ative colitis, UC)的发病, 临床研究表明UC患者血清中自身抗体不仅滴度增加, 而且与病情及治疗相关. 自身抗体形成过程的深入研究有可能为临床诊治提供更多思路.
本课题组前期研究发现, 免疫复合物联合三硝基苯磺酸(trinitroben-zene sulfonic acid)诱导的结肠炎模型比传统方法更符合T细胞与B细胞共同作用所致的IBD的要求. 本文即选择免疫复合联合TNBS诱导结肠炎模型, 旨在了解Tfh细胞在UC发病中可能发生的变化.
UC的发病机制尚未完全清楚, 过去的研究主要集中在细胞免疫方面, 体液免疫方面的研究较少. 抗体形成是体液免疫过程中的重要环节, 对自身抗体形成机制的深入研究有可能为UC治疗提供新的靶点.
本文文选题好, 实验设计合理, 结论可信度强. 具有很强的临床指导意义.
编辑 田滢 电编 都珍珍
| 1. | Zeng Z, Zhu Z, Yang Y, Ruan W, Peng X, Su Y, Peng L, Chen J, Yin Q, Zhao C. Incidence and clinical characteristics of inflammatory bowel disease in a developed region of Guangdong Province, China: a prospective population-based study. J Gastroenterol Hepatol. 2013;28:1148-1153. [PubMed] [DOI] |
| 3. | Hanauer SB. Inflammatory bowel disease: epidemiology, pathogenesis, and therapeutic opportunities. Inflamm Bowel Dis. 2006;12 Suppl 1:S3-S9. [PubMed] |
| 4. | Schaerli P, Willimann K, Lang AB, Lipp M, Loetscher P, Moser B. CXC chemokine receptor 5 expression defines follicular homing T cells with B cell helper function. J Exp Med. 2000;192:1553-1562. [PubMed] [DOI] |
| 5. | Pelletier N, McHeyzer-Williams LJ, Wong KA, Urich E, Fazilleau N, McHeyzer-Williams MG. Plasma cells negatively regulate the follicular helper T cell program. Nat Immunol. 2010;11:1110-1118. [PubMed] |
| 6. | Fazilleau N, Mark L, McHeyzer-Williams LJ, McHeyzer-Williams MG. Follicular helper T cells: lineage and location. Immunity. 2009;30:324-335. [PubMed] [DOI] |
| 7. | Simpson N, Gatenby PA, Wilson A, Malik S, Fulcher DA, Tangye SG, Manku H, Vyse TJ, Roncador G, Huttley GA. Expansion of circulating T cells resembling follicular helper T cells is a fixed phenotype that identifies a subset of severe systemic lupus erythematosus. Arthritis Rheum. 2010;62:234-244. [PubMed] [DOI] |
| 8. | Vinuesa CG, Sanz I, Cook MC. Dysregulation of germinal centres in autoimmune disease. Nat Rev Immunol. 2009;9:845-857. [PubMed] [DOI] |
| 9. | Yamamoto-Furusho JK, Miranda-Pérez E, Fonseca-Camarillo G, Sánchez-Muñoz F, Barreto-Zuñiga R, Dominguez-Lopez A. Interleukin 21 expression is increased in rectal biopsies from patients with ulcerative colitis. Inflamm Bowel Dis. 2010;16:1090. [PubMed] [DOI] |
| 10. | Powrie F, Leach MW, Mauze S, Caddle LB, Coffman RL. Phenotypically distinct subsets of CD4+ T cells induce or protect from chronic intestinal inflammation in C. B-17 scid mice. Int Immunol. 1993;5:1461-1471. [PubMed] [DOI] |
| 11. | Murano M, Maemura K, Hirata I, Toshina K, Nishikawa T, Hamamoto N, Sasaki S, Saitoh O, Katsu K. Therapeutic effect of intracolonically administered nuclear factor kappa B (p65) antisense oligonucleotide on mouse dextran sulphate sodium (DSS)-induced colitis. Clin Exp Immunol. 2000;120:51-58. [PubMed] |
| 12. | Chevrier S, Genton C, Kallies A, Karnowski A, Otten LA, Malissen B, Malissen M, Botto M, Corcoran LM, Nutt SL. CD93 is required for maintenance of antibody secretion and persistence of plasma cells in the bone marrow niche. Proc Natl Acad Sci U S A. 2009;106:3895-3900. [PubMed] [DOI] |
| 13. | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) Method. Methods. 2001;25:402-408. [PubMed] |
| 14. | Kucharzik T, Maaser C, Lügering A, Kagnoff M, Mayer L, Targan S, Domschke W. Recent understanding of IBD pathogenesis: implications for future therapies. Inflamm Bowel Dis. 2006;12:1068-1083. [PubMed] [DOI] |
| 15. | King C, Tangye SG, Mackay CR. T follicular helper (TFH) cells in normal and dysregulated immune responses. Annu Rev Immunol. 2008;26:741-766. [PubMed] [DOI] |
| 17. | 张 静, 付 妤, 邹 开芳, 姬 娟娟, 杨 建美, 钱 伟. 雷公藤甲素对小鼠实验性结肠炎Th17/Treg的调节作用. 胃肠病学和肝病学杂志. 2011;20:1118-1121. |
| 18. | Ebert EC, Geng X, Bajpai M, Pan Z, Tatar E, Das KM. Antibody to tropomyosin isoform 5 and complement induce the lysis of colonocytes in ulcerative colitis. Am J Gastroenterol. 2009;104:2996-3003. [PubMed] [DOI] |
| 19. | Jürgens M, Laubender RP, Hartl F, Weidinger M, Seiderer J, Wagner J, Wetzke M, Beigel F, Pfennig S, Stallhofer J. Disease activity, ANCA, and IL23R genotype status determine early response to infliximab in patients with ulcerative colitis. Am J Gastroenterol. 2010;105:1811-1819. [PubMed] [DOI] |
| 20. | Boone DL, Dassopoulos T, Lodolce JP, Chai S, Chien M, Ma A. Interleukin-2-deficient mice develop colitis in the absence of CD28 costimulation. Inflamm Bowel Dis. 2002;8:35-42. [PubMed] |
| 21. | Kojima R, Kuroda S, Ohkishi T, Nakamaru K, Hatakeyama S. Oxazolone-induced colitis in BALB/C mice: a new method to evaluate the efficacy of therapeutic agents for ulcerative colitis. J Pharmacol Sci. 2004;96:307-313. [PubMed] [DOI] |
| 22. | Elson CO, Cong Y, McCracken VJ, Dimmitt RA, Lorenz RG, Weaver CT. Experimental models of inflammatory bowel disease reveal innate, adaptive, and regulatory mechanisms of host dialogue with the microbiota. Immunol Rev. 2005;206:260-276. [PubMed] [DOI] |
| 23. | Clapper ML, Cooper HS, Chang WC. Dextran sulfate sodium-induced colitis-associated neoplasia: a promising model for the development of chemopreventive interventions. Acta Pharmacol Sin. 2007;28:1450-1459. [PubMed] |
| 25. | Elenius K, Salmivirta M, Inki P, Mali M, Jalkanen M. Binding of human syndecan to extracellular matrix proteins. J Biol Chem. 1990;265:17837-17843. [PubMed] |
| 26. | Mali M, Jaakkola P, Arvilommi AM, Jalkanen M. Sequence of human syndecan indicates a novel gene family of integral membrane proteoglycans. J Biol Chem. 1990;265:6884-6889. [PubMed] |
| 27. | Wijdenes J, Vooijs WC, Clément C, Post J, Morard F, Vita N, Laurent P, Sun RX, Klein B, Dore JM. A plasmocyte selective monoclonal antibody (B-B4) recognizes syndecan-1. Br J Haematol. 1996;94:318-323. [PubMed] [DOI] |
| 28. | Costes V, Magen V, Legouffe E, Durand L, Baldet P, Rossi JF, Klein B, Brochier J. The Mi15 monoclonal antibody (anti-syndecan-1) is a reliable marker for quantifying plasma cells in paraffin-embedded bone marrow biopsy specimens. Hum Pathol. 1999;30:1405-1411. [PubMed] |
| 29. | Chilosi M, Adami F, Lestani M, Montagna L, Cimarosto L, Semenzato G, Pizzolo G, Menestrina F. CD138/syndecan-1: a useful immunohistochemical marker of normal and neoplastic plasma cells on routine trephine bone marrow biopsies. Mod Pathol. 1999;12:1101-1106. [PubMed] |
| 30. | O'Connell FP, Pinkus JL, Pinkus GS. CD138 (syndecan-1), a plasma cell marker immunohistochemical profile in hematopoietic and nonhematopoietic neoplasms. Am J Clin Pathol. 2004;121:254-263. [PubMed] [DOI] |