修回日期: 2009-04-18
接受日期: 2009-04-20
在线出版日期: 2009-05-28
目的: 研究正常胃黏膜及胃癌组织中caveolin-1、Dnmt1蛋白的表达, 并探讨caveolin-1、Dnmt1基因与胃癌发生发展的关系及其临床意义.
方法: 采取甲基化特异性聚合酶链反应(methylation-specific PCR, MSP)检测不同分化程度的60例胃癌组织(其中包括新鲜组织50例、石蜡包埋组织10例)和14例正常胃组织中caveolin-1基因启动子区域甲基化状态; 同时用SP免疫组织化学法、原位杂交法检测caveolin-1蛋白、Dnmt1蛋白及mRNA的表达.
结果: 14例正常胃组织中, 未检测到caveolin-1基因甲基化; 在60例胃癌组织中, 检测到44例胃癌组织中存在甲基化, 甲基化发生率为73.33%, 两组间差异具有统计学意义(P<0.005). caveolin-1基因甲基化的发生与患者年龄有关. 60例胃癌标本中, caveolin-1蛋白阳性表达率仅为30%(18/60), Dnmt1蛋白阳性表达率为63.3%(38/60), Dnmt1基因mRNA阳性表达率为53.3%(32/60).
结论: 在胃癌组织中, caveolin-1基因可能在Dnmt1基因的作用下发生甲基化, 丧失其活性, 进而导致胃癌的发生、发展.
引文著录: 刘斌, 顾立萍, 邢传平, 哈英娣, 高自芳, 苏勤军, 张俊会, 钱震, 董亮. caveolin-1、Dnmt1基因与胃癌发生发展的关系及其临床意义. 世界华人消化杂志 2009; 17(15): 1561-1566
Revised: April 18, 2009
Accepted: April 20, 2009
Published online: May 28, 2009
AIM: To investigate the expression of caveolin-1and Dnmt1 genes in normal gastric mucosa and gastric carcinoma, and to detect methylation status of CpG island of caveolin-1 gene promoter region located in exon 1 and its clinical significance in gastric carcinoma.
METHODS: Methylation status of caveolin-1 gene in 60 gastric carcinoma cases and 14 normal gastric tissues was detected using Methylation-specific PCR (MSP). SP immunohistochemcal method and in site hybridization (ISH) were used to detect the expression of caveolin-1 protein and Dnmt1 protein and mRNA.
RESULTS: The methylation rate of the 5' CpG island of caveolin-1 gene was 0% in 14 normal gastric tissues, and 73.3% in 60 gastric carcinoma cases. There was significant difference between two groups (P < 0.005). Methylation status of caveolin-1 gene was related to the patient's age. The positive rates of caveolin-1 protein, Dnmt1 protein and mRNA were 30%, 63.3% and 53.3% in 60 gastric carcinoma cases.
CONCLUSION: The methylation and inactivation of caveolin-1 gene leads to carcinogenesis and development of gastric carcinomas by the function of Dnmt1 gene.
- Citation: Liu B, Gu LP, Xing CP, Ha YD, Gao ZF, Su QJ, Zhang JH, Qian Z, Dong L. Clinical significance and association of caveolin-1 and Dnmt1 gene with carcinogenesis, development of gastric carcinomas. Shijie Huaren Xiaohua Zazhi 2009; 17(15): 1561-1566
- URL: https://www.wjgnet.com/1009-3079/full/v17/i15/1561.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i15.1561
DNA甲基化不仅与基因调节机制密切相关, 还涉及胚胎发育、基因组印迹、X染色体失活、肿瘤的发生, 而且基因CpG岛区域过度甲基化对基因的表达发挥着重要的调节作用, 可导致基因在转录水平沉默[1]. 在人类多种肿瘤中, 甲基化改变通常发生于正常情况下未甲基化的启动子CpG岛区域[2]. 启动子CpG岛区域的超甲基化状态可以使一些抑癌基因(tumor suppressor genes)失活, 目前已在胃癌组织中检测到多种抑癌基因启动子区域CpG岛的过度甲基化以及该基因的失活, 如p73、p16、E-cadherin、SOCS-1、RIZ1、RUNX3、Cyclin D2、hMLH1、CDH1、RAR-beta等. 抑癌基因的DNA甲基化被人们认为可能是导致胃癌众多因素中的一个重要机制, 是胃癌发生过程中的重要分子事件. Engelman et al[3]发现, 在人类乳腺癌细胞系中, caveolin-1基因由于5'端启动子CpG岛区域存在甲基化, 而使该抑癌基因失活, 导致肿瘤的发生. 本实验室已采用免疫组织化学染色方法和原位杂交技术对胃癌组织中caveolin-1基因的表达状况进行了研究, 并发现caveolin-1基因在正常胃黏膜→不典型增生胃黏膜→胃癌中阳性表达率逐渐降低, 且组间差异性有统计学意义, 在胃癌组织中的阳性表达率仅为23.9%[4-5]. 为探究caveolin-1基因在胃癌组织中表达降低乃至缺失的原因, 我们采用敏感性较高的甲基化特异性聚合酶链反应(methylation-specific PCR, MSP)检测60例胃癌组织(其中包括新鲜组织50例、石蜡包埋组织10例)、14例正常胃组织中的caveolin-1基因外显子1启动子CpG岛区域的甲基化状态, 并对此74例标本中caveolin-1蛋白、Dnmt1蛋白及Dnmt1基因mRNA的表达状况进行检测, 旨在研究caveolin-1基因异常甲基化及Dnmt1基因在胃癌发生发展中的作用.
50例新鲜胃癌组织、10例石蜡标本及14例正常胃组织来自2007-05/2007-09在中国人民解放军兰州军区兰州总医院切除的胃癌标本. 胃癌组包括男52例, 女8例, 年龄31-74(中位年龄60)岁. 所有标本术前均未行放疗和化疗. 所有标本均进行HE、免疫组织化学染色、原位杂交及MSP试验. MSP试剂盒购于美国Chemicon公司. caveolin-1基因外显子1的甲基化和非甲基化引物由大连宝生物工程有限公司合成, Tap酶、DL2000、琼脂糖粉、200 µL扩增管也购于该公司. caveolin-1抗体为鼠抗人mAb(稀释度为1∶400)购于美国基因公司. Dnmt1抗体为鼠抗人mAb(原液浓度为400 mg/L, 工作液浓度为1.5 mg/L)购于美国Alexis公司. Pan-Path REMBRANT® Universal RISH & HRP Detection Kit(原位杂交检测试剂盒)购于Pan-Path公司, Dnmt1基因(基因序列号为NM_001379)寡核苷酸探针为5'-TGGGAGGGTGGGTCTTGGAG-3', 探针片段长度20 bp, 两端标记地高辛, 由上海生工生物工程技术服务有限公司合成.
1.2.1 新鲜组织及石蜡包埋组织中DNA的提取: 采用本实验室改进的运用饱和酚-氯仿抽提法从新鲜组织及石蜡包埋组织中提取DNA[6], 通过紫外分光光度仪检测DNA含量, 从中选取A260/A280在1.8-2.0的标本, 并应用电泳技术对DNA的完整性进行检测, 选取理想标本进行甲基化修饰. 提取组织冻存于-40℃.
1.2.2 DNA甲基化修饰: 甲基化修饰严格按照试剂盒说明书进行, 修饰步骤简述如下: DNA修饰过程; 脱盐处理; 完全甲基化(脱磺酸基作用); 二次脱盐; DNA纯化. 置于-40℃备用.
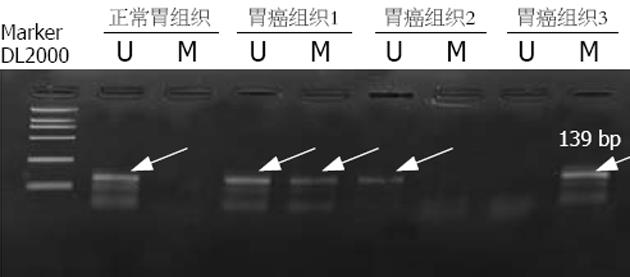
1.2.3 甲基化特异性聚合酶链反应(MSP): 根据GenBank中caveolin-1基因外显子1的基因序列(AF095591), 采用Prime 5.0软件, 针对外显子1的启动子CpG岛区域设计并合成甲基化引物(methylation primer)及非甲基化引物(unmethylation primer), 产物大小为139 bp(表1). PCR运用25 µL反应体系: 2.5 µL dNTP Mixture(各2.5 µmol/L); 2.5 µL 10×PCR Buffer(Mg2+ Plus); 0.5 µg模板; 上、下游引物(20 µmol/L)各1.5 µL(非甲基化为2.0 µL); 0.3 µL Taq酶(5 U/µL)(非甲基化为0.5 µL); 其余用灭菌三蒸水补足25 µL. 循环数设置为30个: 95.5℃预变性5 min; 95.5℃变性30 s; 58.0℃(非甲基化为48.0℃)退火45 s; 72.0℃复性45 s; 72.0℃延伸7 min; 实验结束温度为40℃. 5 µL PCR产物用20 g/L的琼脂糖凝胶电泳、溴化乙锭染色后观察, 在紫外灯下观察, 凝胶成像系统成像.
| 引物名称 | 引物序列(5'→ 3') | 产物长度(bp) |
| caveolin-1-M | gggttcaaagcgggaaaatg(Sense) | 139 |
| taggcactccccaaggttct(Antisense) | ||
| caveolin-1-U | gggtttaaagtgggaaaatg(Sense) | 139 |
| taaacactccccaaaattct(Antisense) |
1.2.4 甲基化判断标准: PCR扩增产物经电泳后, 出现一条或两条139 bp特异性目的条带视为实验成功; 反之, 则视为实验失败, 需重新实验.
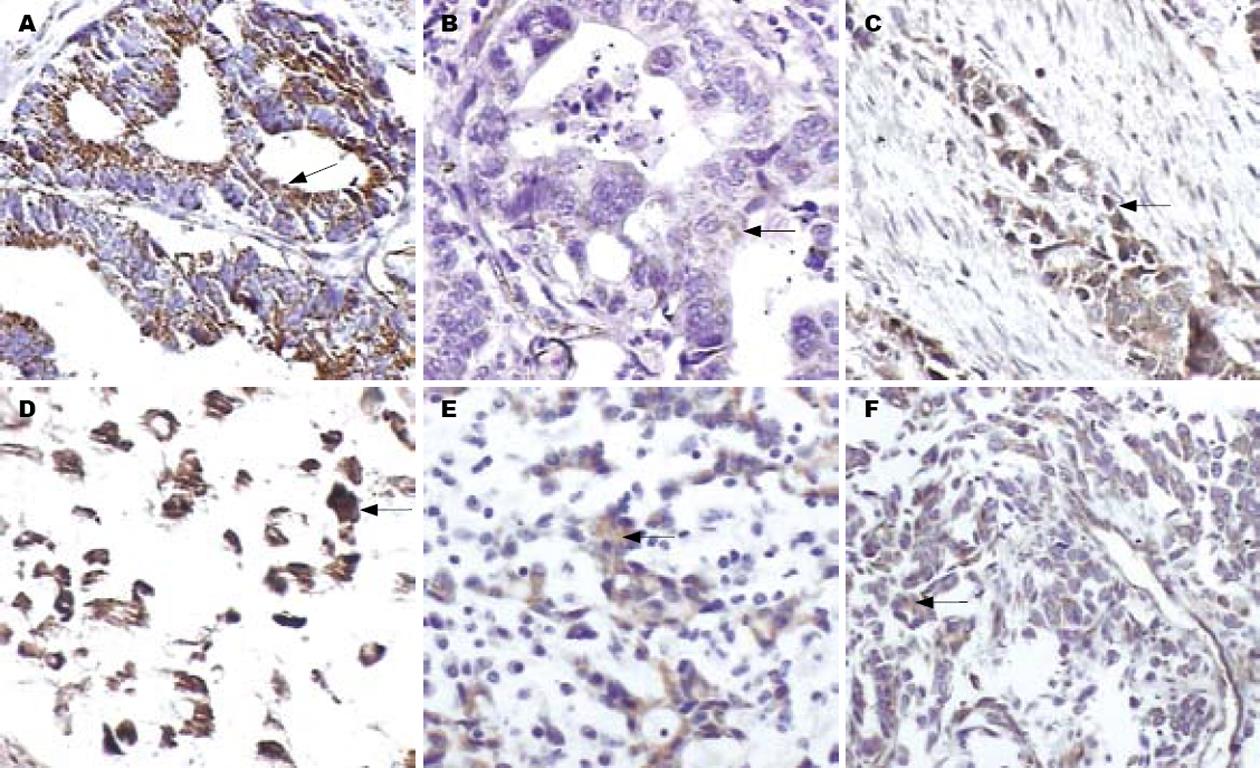
1.2.5 caveolin-1基因、Dnmt1基因的蛋白及Dnmt1基因mRNA表达检测(免疫组织化学SP法及原位杂交): 免疫组织化学操作按照SP试剂盒所附说明进行. 原位杂交技术: 整个实验操作均在无RNA酶的环境下进行, 切片厚4 μm, 组织切片经二甲苯脱蜡, 梯度酒精水化, 37℃经蛋白酶消化30 min; 在无水乙醇中脱水10 s, 每张切片上滴加一滴探针溶液, 盖上盖玻片37℃过夜; TBS冲洗去除盖玻片, TBS洗片3×3 min; 加2-3滴地高辛抗体37℃作用30 min; TBS洗片3×3 min; DAB显色; 苏木素复染; 以TBS缓冲液代替探针作阴性对照. 本实验室先前研究显示: 在正常胃黏膜, caveolin-1蛋白表达均位于细胞质内, Dnmt1蛋白不表达(除部分增生的小凹和间质的淋巴细胞胞核). 原位杂交结果: 在正常胃黏膜, Dnmt1基因mRNA不表达. 病变区域, caveolin-1蛋白不表达或着色减弱、Dnmt1蛋白阳性表达、Dnmt1基因mRNA阳性表达都判定为蛋白或mRNA表达异常.
统计学处理 采用χ2检验, 使用SPSS10.0统计软件包进行统计学处理, 显著性水准α = 0.05.
在14例正常胃黏膜中, caveolin-1蛋白表达均位于细胞质内, Dnmt1蛋白不表达(除部分增生的小凹和间质的淋巴细胞胞核), Dnmt1基因mRNA不表达. 60例胃癌组织中, caveolin-1蛋白阳性表达率仅为30.0%(9/30)(图1A-B), Dnmt1蛋白阳性表达率为63.3%(38/60)(图1C-D), Dnmt1基因mRNA阳性表达率为53.3%(32/60)(图1E-F, 表2).
| caveolin-1 | caveolin-1蛋白 | Dnmt1蛋白 | Dnmt1基因mRNA | 合计 | |||
| + | - | + | - | + | - | ||
| 甲基化(+) | 6 | 38 | 32 | 12 | 28 | 16 | 44 |
| 甲基化(-) | 12 | 4 | 6 | 10 | 4 | 12 | 16 |
| 合计 | 18 | 42 | 38 | 22 | 32 | 28 | 60 |
| 阳性率(%) | 30.0 | 63.3 | 53.3 | 73.3 | |||
用caveolin-1基因甲基化引物caveolin-1-M和非甲基化引物caveolin-1-U分别对修饰后的14例正常胃组织和60例胃癌组织DNA进行扩增. 14例正常胃标本均显示caveolin-1基因启动子区CpG岛甲基化阴性而非甲基化阳性. 60例胃癌标本中, 73.3%(44/60)的癌组织检测出caveolin-1基因外显子1启动子CpG岛区域异常甲基化, 其中26例癌组织(43.3%)表现为完全甲基化; 18例癌组织(30.0%)表现为部分甲基化. 癌组织caveolin-1基因甲基化率显著高于正常组织(Fisher确切概率发P<0.0005, 图2, 表3).
| 分组 | 甲基化(+) | 甲基化(-) | 合计 | 阳性率(%) | P值 |
| 正常组 | 0 | 14 | 14 | 0 | |
| 胃癌组 | 44 | 16 | 60 | 73.3 | <0.0005 |
| 合计 | 44 | 30 | 74 | 59.5 |
经χ2检验, caveolin-1基因外显子1启动子CpG岛区域甲基化发生率在性别、肿物大小、有无脉管侵犯、有无淋巴结转移和浸润深度各组内阳性表达率差异无统计学意义(P>0.05), 而与年龄有关(P<0.05, 表4).
胃癌的发生是一个多阶段、多步骤的过程, 涉及肿瘤相关基因的遗传学(genetics)与表遗传学(epigenetics)的改变[7-8]. DNA甲基化紊乱与胃癌的发生密切相关. DNA甲基化通常发生在基因的CpG岛, 所谓CpG岛(CpG island)即是基因组中富含CpG二核苷酸的区域, 通常位于基因的5'端启动子区域, 呈不连续分布, 是基因具有活性的标志[9]. 正常生理情况下, CpG岛多为非甲基化状态. 近来研究表明, 在人类基因组中, 基因组总体水平降低和部分基因启动子区域高甲基化状况共存是DNA甲基化的总特征. DNA甲基化状态改变是肿瘤抑制基因的失活方式之一, 他通过基因机制和基因外机制导致细胞增殖和分化的相关基因表达异常, 造成细胞失去正常的基因调控而发生恶变. 抑癌基因启动子区域的CpG岛甲基化是某些人类恶性肿瘤的频发事件[10].
Caveolae(胞膜窖)是细胞表面特异性内陷所形成的烧瓶样结构, caveolin-1(窖蛋白)是caveolae的标志性蛋白[11], 在许多生理、病理活动中都起重要作用, 是各种信号分子和信号通路的整和器. 研究证明caveolin-1与细胞的恶性转化及肿瘤的演进密切相关. 本实验室先前的研究表明: caveolin-1基因在正常胃黏膜→不典型增生胃黏膜→胃癌中阳性表达率逐渐降低, 且组间差异性有统计学意义, 在胃癌组织中的阳性表达率仅为23.9%[4-5], 明显低于正常组织, 且其表达的抑制发生于转录或转录前的水平, 并推测可能与该基因甲基化有关. 本实验针对caveolin-1蛋白的表达状况表明: caveolin-1在正常胃黏膜组织中呈强阳性表达, 而在胃癌组织中表达显著降低乃至部分缺失. 对胃癌组织中caveolin-1基因甲基化状态的研究表明: 14例正常胃标本均显示caveolin-1基因启动子区域CpG岛甲基化阴性而非甲基化阳性; 60例胃癌标本中, 73.3%(44/60)的癌组织检测出caveolin-1基因启动子区域CpG岛异常甲基化. caveolin-1基因在胃癌中的沉默原因就在于该基因发生甲基化. 实验亦表明: caveolin-1基因甲基化的发生与年龄有关, 这与先前学者对于胃癌的研究结果相一致: 胃癌多发生于老年人; 部分肿瘤相关基因的甲基化与年龄有关, 但甲基化极少发生于青年个体[12].
在研究了caveolin-1基因甲基化状况的同时, 我们还对其可能的调节机制进行了初步的探索. DNA甲基化是指在DNA甲基转移酶DNMTS(DNA methyltrans-ferases)的介导下(包括Dnmt1、Dnmt2、Dnmt3a、Dnmt3b), 二核苷酸中胞嘧啶(c)的第5位C原子上的H被S-腺苷甲硫氨酸提供的甲基取代, 使之变成5-甲基胞嘧啶(5-methylcytosine, m5C)[13-14]的化学修饰过程. 目前的研究结果表明Dnmt1基因与DNA甲基化关系密切, 他具有维持甲基化的作用. 我们的实验结果表明: 在正常胃黏膜中, Dnmt1蛋白不表达(除部分增生的小凹和间质的淋巴细胞胞核), Dnmt1基因mRNA亦不表达蛋白; 而在胃癌组织中, Dnmt1蛋白阳性表达率为63.3%(38/60), Dnmt1基因mRNA阳性表达率为53.3%. 在胃癌组织中, Dnmt1的活性明显提高. 综合以上实验结果, 我们初步推测: 在胃癌组织中, Dnmt1蛋白及mRNA的表达显著提高, 在其作用下caveolin-1基因外显子1启动子CpG岛区域发生甲基化, 进而使其蛋白表达异常, 以致该基因失活, 失去对肿瘤发生的抑制作用. 这仅是本实验的一些初步推测, 其具体机制, 还有待于我们今后的实验进一步证实.
目前, 对于caveolin-1基因在胃癌组织中的作用机制还不是很清楚, 但实验结果一致表明caveolin-1基因在胃癌组织中的表达下调. 根据本实验结果, 我们初步判断其原因是该基因发生了甲基化. 由于caveolin-1通常与caveolin-2相互作用, 共同形成异寡聚体而发挥作用, 在caveolin-1基因沉默时, caveolin-2基因的表达状况如何, 二者具有何种联系, 还有待于进一步研究. 在胃癌的研究中, 已发现多种抑癌基因发生甲基化改变且具有肿瘤特异性[15-17], 多基因甲基化的肿瘤患者往往预后较差[18]. 在本实验的基础上, 今后可以建立胃癌中相关基因的甲基化谱, 并研究DNMTS家族的作用及具体机制, 为胃癌的预防、早期诊断和抗甲基化治疗提供实验和理论依据. H pylori感染已被证明与胃癌的发生有关, 他与基因甲基化之间是否有关, 为我们今后的胃癌研究提供了新的课题.
本实验室的先前研究结果表明caveolin-1基因在胃癌组织中低表达甚至缺失, 推测其表达抑制发生在蛋白水平以前. 大量的实验表明, Dnmt1的活性在肿瘤中表达增高, 且这可能与DNA甲基化及肿瘤的发生、发展有关, 但Dnmt1在胃癌中的表达及其与肿瘤发生发展的关系研究报道较少, 胃癌组织中caveolin-1基因的低表达与Dnmt1的关系如何, 则未见相关文献报道.
汪思应, 教授, 安徽医科大学实验动物中心; 钱睿哲, 教授, 复旦大学上海医学院生理与病理生理学系血管分子生物学实验室.
近几年研究发现DNA序列以外的调控机制异常在肿瘤的发生、发展过程中更为普遍、也更为重要, 这种调控机制被称为表遗传学. DNA甲基化是表遗传学主要形式, 现已成为近来备受关注的热点问题. DNA甲基化及相关基因在肿瘤发生中的关系及作用机制已成为急需解决的问题.
目前研究表明, caveolin-1能抑制癌细胞的转移, 促进癌细胞的分化; 在多种肿瘤中表达下降, 他在胃癌中的表达亦是如此, 且与胃癌的发生及演进过程密切相关.
本文从分子水平初步揭示了caveolin-1基因在胃癌中失活的原因, 即该基因启动子区域CpG岛的甲基化.
在本实验的基础上, 今后可以建立胃癌中相关基因的甲基化谱, 并研究DNMTS家族的作用及具体机制, 为胃癌的预防、早期诊断和抗甲基化治疗提供实验和理论依据.
本研究选题新颖, 结果可靠, 具有一定的意义.
编辑:李军亮 电编:何基才
| 1. | Baylin SB, Herman JG, Graff JR, Vertino PM, Issa JP. Alterations in DNA methylation: a fundamental aspect of neoplasia. Adv Cancer Res. 1998;72:141-196. [PubMed] [DOI] |
| 2. | Esteller M, Corn PG, Baylin SB, Herman JG. A gene hypermethylation profile of human cancer. Cancer Res. 2001;61:3225-3229. [PubMed] [DOI] |
| 3. | Engelman JA, Zhang XL, Lisanti MP. Sequence and detailed organization of the human caveolin-1 and -2 genes located near the D7S522 locus (7q31.1). Methylation of a CpG island in the 5' promoter region of the caveolin-1 gene in human breast cancer cell lines. FEBS Lett. 1999;448:221-230. [PubMed] [DOI] |
| 4. | 刘 斌, 杨 育生, 邢 传平, 高 自芳, 顾 立萍, 钱 震, 董 亮, 苏 勤军. Caveolin-1基因的mRNA和蛋白在胃癌组织的表达. 第四军医大学学报. 2007;28:1868-1871. |
| 5. | 杨 育生, 刘 斌, 邢 传平, 高 自芳, 顾 立萍, 钱 震, 董 亮, 苏 勤军. 胃癌组织中Caveolin-1、nm23及MMP-2的表达及其意义. 世界华人消化杂志. 2007;15:1725-1730. [PubMed] |
| 7. | Tamura G. Genetic and epigenetic alterations of tumor suppressor and tumor-related genes in gastric cancer. Histol Histopathol. 2002;17:323-329. [PubMed] |
| 8. | Nardone G. Review article: molecular basis of gastric carcinogenesis. Aliment Pharmacol Ther. 2003;17 Suppl 2:75-81. [PubMed] [DOI] |
| 9. | Jones PA, Takai D. The role of DNA methylation in mammalian epigenetics. Science. 2001;293:1068-1070. [PubMed] [DOI] |
| 10. | Kuroki T, Trapasso F, Yendamuri S, Matsuyama A, Alder H, Mori M, Croce CM. Allele loss and promoter hypermethylation of VHL, RAR-beta, RASSF1A, and FHIT tumor suppressor genes on chromosome 3p in esophageal squamous cell carcinoma. Cancer Res. 2003;63:3724-3728. [PubMed] |
| 11. | Razani B, Schlegel A, Liu J, Lisanti MP. Caveolin-1, a putative tumour suppressor gene. Biochem Soc Trans. 2001;29:494-499. [PubMed] [DOI] |
| 12. | Tamura G. Promoter methylation status of tumor suppressor and tumor-related genes in neoplastic and non-neoplastic gastric epithelia. Histol Histopathol. 2004;19:221-228. [PubMed] |
| 13. | Jeltsch A. Beyond Watson and Crick: DNA methylation and molecular enzymology of DNA methyltransferases. Chembiochem. 2002;3:274-293. [PubMed] [DOI] |
| 14. | Cheng X, Roberts RJ. AdoMet-dependent methylation, DNA methyltransferases and base flipping. Nucleic Acids Res. 2001;29:3784-3795. [PubMed] [DOI] |
| 15. | Luo D, Zhang B, Lv L, Xiang S, Liu Y, Ji J, Deng D. Methylation of CpG islands of p16 associated with progression of primary gastric carcinomas. Lab Invest. 2006;86:591-598. [PubMed] |
| 16. | Zhou YN, Xu CP, Han B, Ji R. [CpG island methylation of E-cadherin gene promoter in gastric carcinoma]. Ai Zheng. 2005;24:1220-1224. [PubMed] |
| 17. | Cai JC, Liu D, Zhang HP, Zhong S, Xia NS. [Frequent promoter hypermethylation of several tumor suppressor genes in gastric carcinoma and foveolar epithelium]. Zhonghua Zhongliu Zazhi. 2007;29:510-513. [PubMed] |
| 18. | Issa JP. Methylation and prognosis: of molecular clocks and hypermethylator phenotypes. Clin Cancer Res. 2003;9:2879-2881. [PubMed] |