修回日期: 2009-01-06
接受日期: 2009-01-12
在线出版日期: 2009-05-08
目的: 观察小分子干扰RNA(siRNA)沉默Livin基因在胃癌BGC-823细胞中的表达, 并探讨Livin基因对胃癌细胞生长、凋亡的影响.
方法: 自行设计两条针对Livin基因的siRNA: Livin-sh-1和Livin-sh-2, 以此构建相应的表达载体并分别转染至对数生长期胃癌BGC-823细胞, 经G418筛选后分别采用半定量RT-PCR检测不同siRNA实验分组细胞BGC-823 mRNA水平变化, 四氮唑盐比色法(MTT)检测细胞增殖、流式细胞仪检测胃癌细胞的凋亡.
结果: siRNA对照组与空siRNA载体组Livin α/β mRNA表达差别无显著性; 但转染siRNA组Livin α/β mRNA表达显著低于空白对照组和空siRNA载体组(Livin α: 0.11±0.07 vs 0.37±0.10, 0.34±0.08; Livin β: 0.13±0.04 vs 0.43±0.09, 0.45±0.11, 均P<0.05). 空白对照组与空siRNA载体组相比, 24、48、96 h和1 wk时细胞生长未受影响; 而siRNA组在转染后24 h和48 h细胞生长未受影响, 但在96 h和1 wk时则被明显抑制(P<0.01). 转染siRNA组的细胞的凋亡率与空白对照组和转染空siRNA载体组相比显著增加(14.85%±1.35% vs 4.51%±0.36%, 6.13%±0.71%, 均P<0.05).
结论: siRNA沉默Livin基因能抑制胃癌细胞的生长, 促进胃癌细胞的凋亡, Livin基因有可能成为胃癌治疗的新靶点.
引文著录: 陈鹏, 孔令斌, 王春松, 杨景玉. siRNA沉默Livin基因对胃癌细胞生长、凋亡的影响. 世界华人消化杂志 2009; 17(13): 1346-1349
Revised: January 6, 2009
Accepted: January 12, 2009
Published online: May 8, 2009
AIM: To investigate the expression and effect of Livin gene silencing by siRNA on growth and apoptosis in gastric cancer BGC-823 cells.
METHODS: Two siRNAs (Livin-sh-1 and Livin-sh-2) were self-designed as expression vector and transfected into gastric cancer BGC-823 cells. After G418 positive clone selection, BGC-823 mRNA was measured by semi-quantitative RT-PCR, cell proliferation detected by MTT, and gastric cell apoptosis by flow cytometry.
RESULTS: Compared with cells without siRNA transfection, expression of Livin α/β mRNA was decreased significantly in siRNA control group (Livin α: 0.11 ± 0.07 vs 0.37 ± 0.10, 0.34 ± 0.08; Livin β: 0.13 ± 0.04 vs 0.43 ± 0.09, 0.45 ± 0.11, all P < 0.05). Compared with empty siRNA vector group, cell growth at 24 h, 48 h, 96 h, and 1 wk was not affected in blank control group. Cell growth in siRNA group was not significantly affected at 24 h and 48 h, but was significantly inhibited at 96 h and 1 wk (P < 0.01). Cell apoptosis was significantly higher in siRNA in transfection group than in non-transfected group or than in empty siRNA vector transfection group (14.85% ± 1.35% vs 4.51% ± 0.36%, 6.13% ± 0.71%, both P < 0.05).
CONCLUSION: Livin gene silenced by siRNA induces growth suppression and apoptosis of gastric cancer BGC-823 cells. Livin gene stands a chance as a new target for gastric cancer treatment.
- Citation: Chen P, Kong LB, Wang CS, Yang JY. Effects of Livin gene silencing by siRNA on apoptosis and proliferation of gastric cancer cells. Shijie Huaren Xiaohua Zazhi 2009; 17(13): 1346-1349
- URL: https://www.wjgnet.com/1009-3079/full/v17/i13/1346.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i13.1346
研究证明, 细胞凋亡过程调控异常与肿瘤发生发展密切相关. 随着对凋亡研究不断深入, 人们发现许多抗肿瘤药物是通过诱导细胞凋亡而发挥作用的. 有研究表明胃癌的发生同地域、幽门螺杆菌(H pylori)感染、N-硝基化合物和饮食等环境因素关系密切[1]. Livin是凋亡抑制蛋白家族(inhibitors of apoptosis proteins, IAPs)中的最新成员, 于2000年由Lin et al从人胎胎肾cDNA文库中发现[2]. 到目前为止, 人体中已发现有8种IAPs家族成员, 其中大部分特异性存在于肿瘤组织中, 少部分存在于正常组织中[3], 并能抑制多种细胞凋亡, 在细胞程序性死亡中发挥重要的作用, 因此, 诱导细胞凋亡已成为开发新抗癌药物的研究热点之一. 本研究为了进一步探讨Livin基因表达对胃癌细胞生长、凋亡的影响, 在既往成功构建小干扰RNA(siRNA)表达载体的基础上, 将上述表达载体转染胃癌BGC-823细胞株, 观察了转染细胞生长速度、细胞凋亡.
人类低分化胃癌细胞株BGC-823购自上海肯强仪器有限公司; pSliencerTM 4.1-CMV neo和E.coli化学感受态细胞购自百奥生物(南通)有限公司. RNA提取试剂盒、Lipofectamine 2000转染试剂盒、G418均购自美国Invitrogen公司、Real-time PCR试剂盒购自上海生工.
1.2.1 引物设计与合成: 采用Oligov6.0基因分析软件, 对人Livin基因序列(GenBank中NM- 139317, NM-022161)进行分析后设计引物序列如下: Livin-1: 5'-ACAAGGTGAGGTGCTTCTGC-3'; Livin-2: 5'-AGTCTCCTGCACACTGTGGACAA-3'.
1.2.2 细胞培养: 人类低分化胃癌细胞株BGC- 823进行常规细胞培养.
1.2.3 分组: siRNA组分别转染pSliencerTM 4.1-CMV neo-sh-1和pSliencerTM 4.1-CMV neo-sh-2); siRNA对照组转染pSliencerTM 4.1-CMV neo-3; 空siRNA载体组转染pSliencerTM 4.1-CMV neo.
1.2.4 细胞转染及RT-PCR检测转染效果: 转染前24 h用2.5 g/L胰蛋白酶消化人低分化胃癌细胞株BGC-823, 具体操作按Invitrogen公司转染试剂Lipofectamin2000操作说明书进行.
1.2.5 MTT法测定细胞生长曲线: 取对数生长的稳定转染细胞的各组细胞, 每孔5×103接种于96孔培养板上, 接种后0-7 d, 用MTT法分别测定个孔吸光度值, 各组细胞均设6个复孔, 取平均值描绘生长曲线.
1.2.6 流式细胞仪检测细胞凋亡: 转染后的胃癌细胞加入培养缓冲液后用流式细胞仪检测各组细胞的凋亡率.
统计学处理 计量数据均以mean±SD表示, 采用SPSS软件, 多组均数间的显著性检验用方差分析, 两组均数间的比较用t检验.
转染siRNA组Livinα/β mRNA表达量明显低于空白对照组和空siRNA载体组(P<0.05); 后两组的Livinα/β mRNA表达量差别无显著性(P>0.05). 但各组中的均显示Livinβ表达量高于Livinα(表1).
| 分组 | Livinα | Livinβ |
| 空白对照组 | 0.37±0.10 | 0.43±0.09 |
| 空SiRNA载体组 | 0.34±0.08 | 0.45±0.11 |
| SiRNA组 | 0.11±0.07 | 0.13±0.04 |
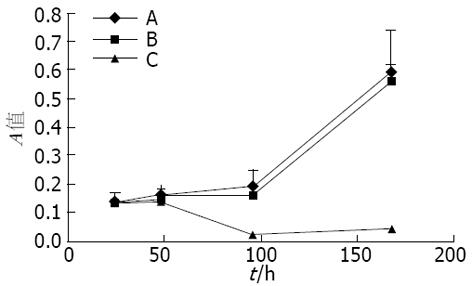
空白对照组与空siRNA载体组相比, 转然后24, 48, 96 h和1 wk时细胞生长未受影响(P>0.05). siRNA组与空白对照组相比在转染后24 h和48 h细胞生长未受明显影响, 而96 h和1 wk时被明显抑制(P<0.01, 图1).
转染siRNA组的细胞的凋亡率显著增加, 与未转组和转染空siRNA载体组比较, 差异有显著性(14.85%±1.35% vs 4.51%±0.36%, 6.13%±0.71%, 均P<0.05), 说明沉默Livin的表达可增加细胞的凋亡.
肿瘤是一种环境因素与遗传因素相互作用所致的一类疾病. 正常细胞中的癌基因和原癌基因等的动态平衡维持着机体内细胞的适当数量和功能, 细胞在各种致瘤因素的作用下, 基因突变引起原癌基因功能过强, 抗癌基因功能丧失, 细胞生长因子及其受体、细胞内的信号传导、细胞周期调控等发生异常, 细胞正常凋亡被抑变成不可控制的生长便可引起肿瘤.
RNA干扰(RNA interference, RNAi)是由双链RNA(double stranded RNA, dsRNA)所引起的序列特异性基因沉默, siRNA是21-23 nt小片段双链RNA, 可以特异性和互补靶基因mRNA序列结合, 诱导其降解, 产生强大的RNA干扰效应[4-5]. siRNA与靶序列之间严格的碱基配对, 具有很强的特异性, 他可以在染色质水平、转录水平、转录后水平和翻译水平中参与基因表达的调节. 尽管RNAi的效果看似和靶序列与siRNA的结合性有关, 但目前并没有可靠的方法来预判或鉴别RNAi的理想靶序列[6]. 有报道指出, 化学合成和载体介导的siRNA在哺乳动物细胞, 包括恶性肿瘤细胞中都能成功的沉默特定的基因[7].
Livin是新近发现的细胞凋亡抑制因子, 他在抑制细胞凋亡上具有多重功能, Livin在正常组织一般不表达或表达很低[8-9], 但在一些肿瘤中却高表达, 这与他在肿瘤细胞中高表达能抑制肿瘤细胞的凋亡有着密切关系. 其有望成为恶性肿瘤的早期诊断及预后评估的可靠指标之一. 对于Livin的表达与恶性肿瘤特征(如侵入行为、减短寿命、抵制治疗、提高复发率等)的相关性, 各家报道不完全一致[10-12], 有待进一步去研究探索, 以期Livin成为指导临床评估的重要指标. 抑制IAP家族成员蛋白表达, 诱导肿瘤细胞发生凋亡, 是目前肿瘤凋亡治疗的一个较有希望的研究方向, 可能为逆转肿瘤耐药以及作为手术、放疗和化疗的辅助治疗手段[13], 在减少肿瘤转移和复发的方面有重要作用.
本研究结果显示, 转染siRNA组Livinα/β mRNA表达量、细胞生长曲线及细胞凋亡明显低于空白对照组和空siRNA载体组, 与Crnkovic-Mertens et al[14]应用siRNA使Livin基因沉默所获得的结果有相似之处. siRNA组与空白对照组相比在转染后24 h和48 h细胞生长未受明显影响, 而96 h和1 wk时被明显抑制. 由此表明, Livin基因表达在细胞增殖和凋亡调控中起重要作用. Liu et al[12]对40例胃癌患者利用Livin干扰技术可明显干扰Livin基因表达, 并使胃癌细胞的凋亡敏感性增加. 通过干预阻断凋亡抑制蛋白Livin表达, 可以促进癌细胞的凋亡[15]. Wagener et al[16]用RT-PCR法检测, Livin蛋白质在肾癌细胞质及细胞核中均过度表达(P = 0.0077).
作为一种新的基因阻断技术, RNAi将会被广泛用于胃癌治疗研究. 现已取得令人瞩目的成就, 但在胃癌的许多研究方面, 如胃癌肿瘤疫苗的研究、寻找对抗胃癌腹膜转移的途径以及探询遗传性胃癌的基因缺陷等, RNAi技术还隐藏着巨大的应用前景, 值得进一步研究和探索, 涉及的相关技术问题也还有待进一步解决.
Livin是凋亡抑制蛋白家族(IAPs)中的最新成员, 于2000年由Lin et al从人胎胎肾cDNA文库中发现. 到目前为止, 人体中已发现有8种IAPs家族成员, 其中大部分特异性存在于肿瘤组织中, 少部分存在于正常组织中, 并能抑制多种细胞凋亡, 在细胞程序性死亡中发挥重要的作用, 因此, 诱导细胞凋亡已成为开发新抗癌药物的研究热点之一.
刘平, 教授, 南京医科大学第一附属医院(江苏省人民医院)肿瘤科.
细胞凋亡过程调控异常与肿瘤发生发展密切相关, 诱导细胞凋亡已成为开发新抗癌药物的研究热点之一.
Crnkovic-Mertens et al应用siRNA使Livin基因沉默; 国内Lin et al对胃癌中Livin表达做了研究, 同样发现胃癌组织中Livin阳性表达率高于正常和癌旁组.
以Livin为靶点的抑制物及反义Livin能够保护细胞不进行凋亡, 具有广谱和低不良反应, 为肿瘤治疗提供了新的研究方向.
本文选题新颖, 具有一定的科学性, 但科研设计需进一步完善.
编辑:李军亮 电编:何基才
| 1. | Matsumoto Y, Marusawa H, Kinoshita K, Endo Y, Kou T, Morisawa T, Azuma T, Okazaki IM, Honjo T, Chiba T. Helicobacter pylori infection triggers aberrant expression of activation-induced cytidine deaminase in gastric epithelium. Nat Med. 2007;13:470-476. [PubMed] [DOI] |
| 2. | Lin JH, Deng G, Huang Q, Morser J. KIAP, a novel member of the inhibitor of apoptosis protein family. Biochem Biophys Res Commun. 2000;279:820-831. [PubMed] [DOI] |
| 3. | Grzybowska-Izydorczyk O, Smolewski P. [The role of the inhibitor of apoptosis protein (IAP) family in hematological malignancies]. Postepy Hig Med Dosw (Online). 2008;62:55-63. [PubMed] |
| 4. | Lopes RB, Gangeswaran R, McNeish IA, Wang Y, Lemoine NR. Expression of the IAP protein family is dysregulated in pancreatic cancer cells and is important for resistance to chemotherapy. Int J Cancer. 2007;120:2344-2352. [PubMed] [DOI] |
| 5. | Fire A, Xu S, Montgomery MK, Kostas SA, Driver SE, Mello CC. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 1998;391:806-811. [PubMed] [DOI] |
| 6. | Wang J, Barr MM. RNA interference in Caenorhabditis elegans. Methods Enzymol. 2005;392:36-55. [PubMed] [DOI] |
| 7. | McManus MT, Sharp PA. Gene silencing in mammals by small interfering RNAs. Nat Rev Genet. 2002;3:737-747. [PubMed] [DOI] |
| 8. | Shi Y. Mammalian RNAi for the masses. Trends Genet. 2003;19:9-12. [PubMed] [DOI] |
| 9. | Ka H, Hunt JS. Temporal and spatial patterns of expression of inhibitors of apoptosis in human placentas. Am J Pathol. 2003;163:413-422. [PubMed] |
| 10. | Kleinberg L, Lie AK, Flørenes VA, Nesland JM, Davidson B. Expression of inhibitor-of-apoptosis protein family members in malignant mesothelioma. Hum Pathol. 2007;38:986-994. [PubMed] [DOI] |
| 11. | Yagihashi A, Asanuma K, Tsuji N, Torigoe T, Sato N, Hirata K, Watanabe N. Detection of anti-livin antibody in gastrointestinal cancer patients. Clin Chem. 2003;49:1206-1208. [PubMed] [DOI] |
| 12. | Liu P, Wang TS, You SH, Ge HM. [Expression of livin in gastric dancer and effect of silencing of the livin gene on apoptosis in gastric cancer cells]. Zhonghua Zhongliu Zazhi. 2007;29:570-574. [PubMed] |
| 13. | Crnković-Mertens I, Muley T, Meister M, Hartenstein B, Semzow J, Butz K, Hoppe-Seyler F. The anti-apoptotic livin gene is an important determinant for the apoptotic resistance of non-small cell lung cancer cells. Lung Cancer. 2006;54:135-142. [PubMed] [DOI] |
| 14. | Crnkovic-Mertens I, Hoppe-Seyler F, Butz K. Induction of apoptosis in tumor cells by siRNA-mediated silencing of the livin/ML-IAP/KIAP gene. Oncogene. 2003;22:8330-8336. [PubMed] [DOI] |
| 15. | Ashhab Y, Alian A, Polliack A, Panet A, Ben Yehuda D. Two splicing variants of a new inhibitor of apoptosis gene with different biological properties and tissue distribution pattern. FEBS Lett. 2001;495:56-60. [PubMed] [DOI] |
| 16. | Wagener N, Crnković-Mertens I, Vetter C, Macher-Göppinger S, Bedke J, Gröne EF, Zentgraf H, Pritsch M, Hoppe-Seyler K, Buse S. Expression of inhibitor of apoptosis protein Livin in renal cell carcinoma and non-tumorous adult kidney. Br J Cancer. 2007;97:1271-1276. [PubMed] [DOI] |