修回日期: 2009-02-12
接受日期: 2009-02-16
在线出版日期: 2009-04-18
目的: 了解E2F-1过表达对胃癌细胞MGC-803增殖、生长和细胞周期的影响, 并探讨E2F-1对胃癌细胞动力学影响的分子机制.
方法: 对稳定转染E2F-1的胃癌MGC-803/E2F-1细胞(实验组)、转染空载体的MGC-803/EV(阴性对照组)及未转染的MGC-803细胞进行MTT法检测, 绘制生长曲线和计算细胞增殖率; 流式细胞仪检测各组细胞周期分布. 提取各组细胞的总RNA, 逆转录成cDNA, 用荧光探针与含有21 522条人类基因表达谱芯片进行杂交. 采用LuxScan 10K/A双通道激光扫描仪扫描芯片上两种荧光信号, 应用LuxScan 3.0图像分析软件对芯片图像进行处理和分析.
结果: 与两个对照组相比, 胃癌MGC-803/E2F-1细胞的生长受到明显抑制, 增殖率下降(26.61%±5.19% vs 93.4%±10.29%, 100%±0.00%, 均P<0.05); 细胞周期阻滞在G0/G1期. 在检测的21 522条基因中, 与细胞增殖、生长和细胞周期相关的差异性表达基因有20条, 上调基因9条, 下调基因11条.
结论: E2F-1基因过表达抑制胃癌细胞的增殖和生长, 细胞周期停滞在G0/G1期, 其分子机制可能与筛选出来的20条差异表达基因有直接的关系.
引文著录: 王连振, 李雷, 王长青, 谢玉波, 解乃昌, 肖强. E2F-1基因过表达对胃癌细胞动力学影响机制. 世界华人消化杂志 2009; 17(11): 1069-1073
Revised: February 12, 2009
Accepted: February 16, 2009
Published online: April 18, 2009
AIM: To understand the effect of E2F-1's over-expression on gastric cancer cell proliferation, growth and cell cycle and to investigate the molecular mechanism of E2F-1's influence on gastric cancer cell dynamics.
METHODS: The MGC-803/ E2F-1 (experimental group) gastric cancer cells which were stably transfected with E2F-1, and containing unpossessed carriers (negative control group), and the cells without transfection were performed MTT test to draw growing curve, and to compute cell proliferation rate. Cell cycles were examined by flow cytometry. The total RNA was extracted, and the cDNA was obtained using reverse transcription polymerase chain reaction (RT-PCR), and then the fluorescent probes were hybridized with gene chip containing 21 522 human 22K gene expression profiles. Subsequently, the two signal images were scanned by Lux Scan 10K/A dual pathways laser scanner and analyzed by LuxScan 3.0 image analysis software.
RESULTS: Compared with two control groups, the growth of the MGC-803 gastric cancer cells stably transfected with E2F-1 was obviously inhibited, and proliferation rate was decreased (26.61% ± 5.19% vs 93.4% ± 10.29%, 100% ± 0.00%, both P < 0.05), cell cycle staged in periods of G0/G1. Of the 21 522 target genes, there were 20 cell proliferation, growth and cell cycle-related differential expression ones. Of the 20 genes, 9 were up-regulated and 11 were down-regulated.
CONCLUSION: E2F-1 overexpression inhibits gastric cancer cell proliferation, growth and cell cycle, then cell cycle remains in periods of G0/G1, and perhaps the molecular mechanism has direct relationship with the 20 selected differential expression genes.
- Citation: Wang LZ, Li L, Wang CQ, Xie YB, Xie NC, Xiao Q. Effects of E2F-1 gene overexpression on gastric cancer cell dynamics. Shijie Huaren Xiaohua Zazhi 2009; 17(11): 1069-1073
- URL: https://www.wjgnet.com/1009-3079/full/v17/i11/1069.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i11.1069
胃癌是世界范围内最常见的恶性肿瘤之一, 也是我国最常见的消化系肿瘤, 全球每年新发胃癌约87万例, 占所有新发癌症病例的9%, 仅次于肺癌、乳腺癌和大肠癌而位居第4位. 每年约有64万人因胃癌死亡, 位居癌症死因的第2位[1]. 转录因子E2F-1是细胞周期调控机制Rb/E2F通路中重要的转录活化因子, 在调控细胞周期进展和细胞增殖生长中起关键性作用[2-3]. 本研究应用MTT法和流式细胞仪检测E2F-1过表达对细胞增殖生长和细胞周期的影响, 并应用基因表达谱芯片技术筛选过表达E2F-1的胃癌细胞中与细胞增殖生长及细胞周期相关的差异表达基因, 以探讨E2F-1影响胃癌细胞增殖生长的分子机制, 为进一步的研究打下基础.
人胃癌MGC-803细胞株购自中国科学院上海生物细胞研究所. 过表达E2F-1的细胞株(MGC-803/E2F-1)和转染空质粒的细胞株(MGC-803/EV)由本室保存. TRIzol(Invitrogen), 流式细胞仪EPICS XL-MCL购自美国Beckman Coulter公司. 基因表达谱芯片采用博奥生物公司提供22k人类基因组寡核苷酸芯片. LuxScan 10K/A双通道激光扫描仪购自CapitalBio公司.
1.2.1 MTT实验: 分别将MGC-803/E2F-1细胞(实验组), MGC-803/EV细胞(阴性对照组)和未转染MGC-803细胞以每孔3×103个接种到96孔板中, 每孔体积100 μL, 每个样品设3个复孔. 将细胞培养皿移入CO2培养箱, 在37 ℃、50 mL/L CO2及饱和湿度环境下培养, 分别于24、48、72、96、120、144、168 h后, 每孔加MTT溶液20 μL呈色, 在37 ℃ CO2培养箱继续孵育4 h, 终止培养, 选择492 nm波长, 在酶联免疫监测仪上测定各孔吸光度值(A值), 并计算细胞增殖率, 细胞增殖率(%) = ATest/AControl×100%.
1.2.2 细胞周期检测: 取对数生长期细胞, 倒去培养液, 胰酶适度消化细胞, 用培养液吹打, 800 r/min离心15 min去上清. 用PBS洗2次, 加0.5 mL PBS吹匀, 然后将细胞打入5 mL 700 mL/L(预冷)乙醇中, 封口膜封口, 4 ℃固定过夜, 用0.4 mL PBS重悬细胞并转至Tube中轻轻吹打, 加RNase-A, 37 ℃水浴消化30 min; 用PI标记在冰浴中避光染色30 min, 300目(孔径40-50 μm)尼龙网过滤, 流式细胞仪EPICS XL-MCL检测样品.
1.2.3 基因表达谱芯片技术: (1)基因芯片扫描: TRIzol一步法提取MGC-803/E2F-1细胞和未转染E2F-1的胃癌MGC-803细胞总RNA, 送博奥生物有限公司检测制备. 芯片用LuxScan 10K/A双通道激光扫描仪(CapitalBio公司)进行扫描. (2)芯片图像的采集与数据分析: 采用LuxScan 3.0图像分析软件(CapitalBio公司)对芯片图像进行分析, 把图像信号转化为数字信号; 然后对芯片上的数据用Lowess方法进行归一化; 最后以差异为1.5倍的标准, 即Cy5/Cy3比值(Ratio)>2或<0.5作为阳性结果, 来确定差异表达基因. (3)基因芯片质量控制Hex、外标、内标等阳性对照信号正常, 阴性对照检测为阴性; 片内看家基因重复性好, Ratio值CV不超过0.3; 无影响数据的污染, 漏点率不超过3‰, 检测率正常.
统计学处理 应用SPSS13.0统计软件进行分析. 计量资料以mean±SD表示, 组间比较采用单因素方差分析(One-way ANOVA)或随机区组设计方差分析(ANOVA of Randomized Complete Block-design). P<0.05为差异有统计学意义.
MGC-803/E2F-1组细胞各时间点的A值均小于MGC-803/EV组和未转染组细胞(表1), 说明MGC-803/E2F-1组细胞的生长速度明显减慢, 其生长增殖率为未转染组的26.61%, 为MGC-803/EV组的28.23%; MGC-803/EV组与未转染组相比, 差异无统计学意义(表2).
| 分组 | 24 h | 48 h | 72 h | 96 h | 120 h | 144 h | 168 h |
| MGC-803/E2F-1 | 0.011±0.001a | 0.020±0.002a | 0.029±0.001a | 0.095±0.004a | 0.158±0.005a | 0.187±0.003a | 0.334±0.006a |
| MGC-803/EV | 0.025±0.002 | 0.068±0.003 | 0.107±0.006 | 0.310±0.006 | 0.755±0.013 | 0.875±0.015 | 1.075±0.024 |
| MGC-803 | 0.031±0.001 | 0.063±0.001 | 0.112±0.004 | 0.334±0.007 | 0.827±0.009 | 0.846±0.016 | 1.331±0.029 |
MGC-803/E2F-1组的细胞周期分布与其余两组比较, 其G0/G1期的比例增加, 而S期的比例减少(表3), 这提示MGC-803/E2F-1组细胞的细胞周期出现G0/G1期阻滞.
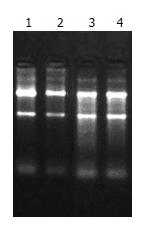
2.3.1 总RNA纯度及完整性鉴定: MGC803/E2F-1组和未转染MGC-803组提取总RNA结果良好, 两组细胞总RNA含量均为80-170 μg, 琼脂糖凝胶电泳结果分析: 28S RNA和18S RNA条带清晰, 且两者条带亮度比值>1, 5S条带模糊, 说明RNA纯度和完整性较好(图1), 可满足后续实验需要.
2.3.2 Cy3信号和Cy5信号计算机叠加图像处理结果: 芯片为22行×22列×48(亚矩阵), 实验组用Cy3标记为绿色, 阴性对照组用Cy5标记为红色. 对于某一点的两种叠加荧光信号, 如果Cy3信号较强, 该点多显绿色(下调趋势); 如果Cy5信号较强, 该点多显红色(上调趋势); 如果信号强度相似, 即显黄色(图2).
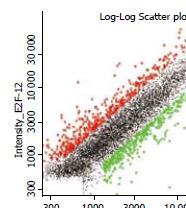
2.3.3 MGC-803细胞组和MGC-803/E2F-1细胞组杂交信号强度: X轴以实验组Cy3荧光强度前景值为横坐标, Y轴以阴性对照组Cy5荧光强度前景值为纵坐标, 每一个数据点代表芯片上一个基因的杂交信号. 红色标记和绿色标记的数据点分别表示Cy5/Cy3的Ratios>2和<0.5, 属于表达有差异的基因; 红色表示表达上调的基因, 绿色表示表达下调的基因; 黑色标记表示Ratio值在0.5和2之间, 表达基本无差异(图3).
2.3.4 生物信息学分析结果: 21 522条人类基因表达谱芯片检测结果显示, 与未转染组MGC-803细胞相比, 以差异倍数2为标准, 检出MGC-803/E2F-1细胞差异表达基因740条, 其中与细胞增殖、生长和细胞周期有关的差异基因20条(表4). 另有功能信息不明的差异基因73条.
| GenBank | Gene symbol | Pathway | Ratio |
| NM_000546 | TP53 | cell growth | 2.0404 |
| cell cycle | |||
| NM_000820 | GAS6 | cell growth | 2.0778 |
| cell proliferation | |||
| NM_001321 | CSRP2 | cell growth | 2.5802 |
| cell proliferation | |||
| NM_018361 | PLCE1 | cell growth | 0.4372 |
| NM_014011 | SOCS5 | cell growth | 0.2701 |
| NM_015934 | NOP5/NOP58 | cell growth | 0.3928 |
| NM_006373 | VAT1 | cell growth | 2.6922 |
| NM_022157 | RRAGC | cell growth | 2.6514 |
| NM_020244 | CHPT1 | cell growth | 0.3288 |
| NM_002087 | GRN | cell proliferation | 4.0888 |
| NM_004494 | HDGF | cell proliferation | 0.4607 |
| NM_002467 | MYC | cell proliferation | 0.1875 |
| NM_002032, NR_002205 | FTH1 | cell proliferation | 2.6732 |
| NM_016082, NM_016408 | CDK5RAP1 | cell proliferation | 0.3539 |
| NM_032637, NM_005983 | SKP2 | cell cycle | 0.4021 |
| NM_006904 | PRKDC | cell cycle | 2.1083 |
| NM_006190 | ORC2L | cell cycle | 0.1933 |
| NM_002358 | MAD2L1 | cell cycle | 0.3756 |
| NM_006306 | SMC1L1 | cell cycle | 0.5192 |
| NM_078467, NM_000389 | CDKN1A | cell cycle | 4.3546 |
基因芯片是伴随着人类基因组计划发展起来的一项高通量筛选技术, 具有低消耗、高灵敏度的特点. 他能在同一实验条件下同时筛检众多基因的差异表达. 目前应用该技术检测肿瘤相关基因的差异表达已成为肿瘤研究的热点并已广泛应用在疾病尤其是肿瘤的基因表达谱分析, 进而成功地应用在肿瘤相关基因功能研究[4]、恶性肿瘤的分子学分型[5-6]、化疗药物作用及耐药机制等[7]研究上.
E2F-1是细胞周期调控机制Rb/E2F通路中重要的转录活化因子, 而细胞周期调控机制的失活在细胞癌变过程中起着至关重要的作用[2-3]. 有研究表明, E2F-1过表达可抑制体外胃癌MKN-45细胞的增殖和生长, 并使其细胞周期停滞在G1/S期[8]. 本实验中同样发现过表达E2F-1的胃癌MGC-803细胞的增殖生长受到了明显抑制, 在细胞周期中出现G1/G0期阻滞. 通过基因表达谱芯片技术分析, 我们还发现了与细胞增殖、生长和细胞周期相关的差异性表达基因20条, 其中上调基因9条, 下调基因11条, 另有功能信息不明的差异基因73条.
表达上调的TP53可以激活P21蛋白, 与多种细胞周期蛋白-细胞周期蛋白依赖性激酶(cyclin-CDK)结合形成三聚体, 抑制G1期cyclin-CDK复合体的激酶活性, 阻止细胞从G1期进入S期, 导致G1期阻滞[9]. 有研究表明E2F-1的过表达能够诱使TP53的多个氨基酸残基磷酸化, 特别是丝氨酸-20的磷酸化, 从而阻止mdm2对TP53结合和降解[10-11]. Teodoro et al的研究表明, TP53还可激活胶原蛋白的脯氨酰羟化酶(prolyl hydroxylase, PHDs), 该酶有抗血管生成特性, 抑制血管再生而阻断其营养来源[12-13]. Pajic et al[14]研究认为c-Myc蛋白是细胞从G0/G1期进入S期的驱动因子, 其转录调控对象如cdc25A、ODC是细胞进入S期所必需的, 抑制其表达就可以抑制细胞由G0/G1期进入S期, 导致细胞的增殖明显下降. ORC(起点识别复合物)是真核DNA复制的启动子. 在启动DNA复制之前, ORC与染色体上的DNA启动位点结合, 与其他起始因子形成复制前复合物(pre replication complex, pre-RC), 使G0期的细胞进入Gl期, 并向S期转化. 有研究显示, 在胃癌细胞周期G1/S转换期, 与DNA代谢有关的基因(如ORC等)准时在G1末期出现, 为即将到来的DNA合成做好准备, 即ORC表达上调[15].
在本实验筛选出的差异基因中, TP53表达上调, CDK、Myc和ORC表达下调, 这些都和已有的研究结果吻合, 提示E2F-1至少可以通过上述信号传导通路抑制胃癌细胞MGC-803的增殖和生长, 并使细胞周期停滞在G1期. 但是, E2F-1的过表达还引起了其他与细胞增殖生长和细胞周期相关的16条基因表达上调或下调, 说明E2F-1还可通过其他的信号通路导致胃癌细胞生物学行为发生改变. 另外, 还有73条功能信息不明的差异基因在E2F-1高表达的情况下也出现了表达改变, 其意义值得进一步研究.
胃癌是世界上第4种常见恶性肿瘤, 每年约87万新发病例, 其死亡率仅次于肺癌, 居世界癌症死亡的第2位. 本研究应用基因表达谱芯片技术探讨E2F-1影响胃癌细胞增殖生长的分子机制, 为进一步的研究打下基础.
李淑德, 主任医师, 中国人民解放军第二军医大学长海医院消化内科.
基因芯片技术在胃癌中的研究已涉及致癌分子的机制, 胃癌的生长、增殖和预后相关基因的表达以及对化疗药物敏感性的评价. 目前研究趋势是应用基因芯片技术对肿瘤表型进行分类, 提高早期诊断率, 预测预后, 指导临床.
本文利用基因芯片技术探讨E2F-1基因过表达对胃癌细胞动力学影响的分子机制, 在检测的21 522条基因中, 与细胞增殖、生长和细胞周期相关的差异性表达基因有20条, 上调基因9条, 下调基因11条. 对于阐明胃癌浸润与转移的机制, 指导临床治疗都有重要意义.
本文为认识E2F-1基因过表达对胃癌细胞动力学影响的分子机制提供了科学依据. 为胃癌的基因治疗和寻找出胃癌早期诊断的分子生物学标志物具有十分重要的意义.
本文探讨E2F-1基因过表达对胃癌细胞动力学影响的分子机制, 对于阐明胃癌浸润与转移的机制, 指导临床治疗都有重要意义.
编辑:李军亮 电编:何基才
| 2. | Kawabe T. G2 checkpoint abrogators as anticancer drugs. Mol Cancer Ther. 2004;3:513-519. [PubMed] |
| 3. | Müller H, Bracken AP, Vernell R, Moroni MC, Christians F, Grassilli E, Prosperini E, Vigo E, Oliner JD, Helin K. E2Fs regulate the expression of genes involved in differentiation, development, proliferation, and apoptosis. Genes Dev. 2001;15:267-285. [PubMed] [DOI] |
| 4. | Clark EA, Golub TR, Lander ES, Hynes RO. Genomic analysis of metastasis reveals an essential role for RhoC. Nature. 2000;406:532-535. [PubMed] [DOI] |
| 5. | de Fraipont F. [Contribution of molecular biology to new diagnostic and/or prognostic markers characterization in cancerogenesis]. Ann Biol Clin (Paris). 2007;65:21-26. [PubMed] |
| 6. | Kadoch C, Treseler P, Rubenstein JL. Molecular pathogenesis of primary central nervous system lymphoma. Neurosurg Focus. 2006;21:E1. [PubMed] [DOI] |
| 7. | Weinstein JN, Scherf U, Lee JK, Nishizuka S, Gwadry F, Bussey AK, Kim S, Smith LH, Tanabe L, Richman S. The bioinformatics of microarray gene expression profiling. Cytometry. 2002;47:46-49. [PubMed] [DOI] |
| 8. | Xiao Q, Li L, Xie Y, Tan N, Wang C, Xu J, Xia K, Gardner K, Li QQ. Transcription factor E2F-1 is upregulated in human gastric cancer tissues and its overexpression suppresses gastric tumor cell proliferation. Cell Oncol. 2007;29:335-349. [PubMed] |
| 9. | Zhao Y, Lu S, Wu L, Chai G, Wang H, Chen Y, Sun J, Yu Y, Zhou W, Zheng Q. Acetylation of p53 at lysine 373/382 by the histone deacetylase inhibitor depsipeptide induces expression of p21(Waf1/Cip1). Mol Cell Biol. 2006;26:2782-2790. [PubMed] [DOI] |
| 10. | Unger T, Juven-Gershon T, Moallem E, Berger M, Vogt Sionov R, Lozano G, Oren M, Haupt Y. Critical role for Ser20 of human p53 in the negative regulation of p53 by Mdm2. EMBO J. 1999;18:1805-1814. [PubMed] [DOI] |
| 11. | 李 慧灵, 陈 小艳, 刘 芳, 黄 作平, 褚 红娟, 王 辛, 张 弓, 赵 彤. 组织微阵列技术对胃癌组织p53和MDM2蛋白表达的同步 检测与对应分析. 世界华人消化杂志. 2008;16:1190-1193. [DOI] |
| 12. | Teodoro JG, Parker AE, Zhu X, Green MR. p53-mediated inhibition of angiogenesis through up-regulation of a collagen prolyl hydroxylase. Science. 2006;313:968-971. [PubMed] [DOI] |
| 13. | Teodoro JG, Evans SK, Green MR. Inhibition of tumor angiogenesis by p53: a new role for the guardian of the genome. J Mol Med. 2007;85:1175-1186. [PubMed] [DOI] |
| 14. | Pajic A, Spitkovsky D, Christoph B, Kempkes B, Schuhmacher M, Staege MS, Brielmeier M, Ellwart J, Kohlhuber F, Bornkamm GW. Cell cycle activation by c-myc in a burkitt lymphoma model cell line. Int J Cancer. 2000;87:787-793. [PubMed] [DOI] |