修回日期: 2009-02-26
接受日期: 2009-03-02
在线出版日期: 2009-04-08
目的: 探讨海洛因依赖对大鼠结肠内分泌细胞表达5-羟色胺(5-HT)和生长抑素(SS)免疫反应(IR)的影响.
方法: 成年SD大鼠, 分为海洛因依赖组、盐水对照组和空白对照组. 按皮下注射法建立海洛因依赖动物模型, 分别于10、17、24、31、38 d取结肠组织. 应用免疫组织化学SABC法及图像分析法分析结肠5-HT-及SS-IR细胞的数量及IR强度的改变.
结果: 与空白及盐水对照组比较, 海洛因依赖组大鼠结肠5-HT-及SS-IR细胞数量明显增多(F = 4.373, 5.708, 均P<0.01), 且以31 d最为显著; 图像分析法显示海洛因依赖期间大鼠结肠内5-HT-及SS-IR细胞的平均灰度值均低于空白及盐水对照组(F = 38.637, 25.091, 均P<0.05), 以31 d时间组最低.
结论: 海洛因依赖期间结肠内分泌细胞合成和分泌5-HT及SS增多, 参与了海洛因依赖期间肠道功能紊乱的调节过程.
引文著录: 洪艳, 梁文妹. 海洛因依赖对大鼠结肠内分泌细胞表达5-HT及生长抑素的影响. 世界华人消化杂志 2009; 17(10): 976-980
Revised: February 26, 2009
Accepted: March 2, 2009
Published online: April 8, 2009
AIM: To explore the effect of heroin dependence on expression of 5-hydroxytryptamine and somatostatin in endocrine cells of rat colon.
METHODS: Normal SD rats were divided into normal control group (NCG), saline control group (SCG), and heroin dependence group (HDG). A heroin dependence model of rats was established by subcutaneous injection of heroin, and colonic tissue was excised on the 10th, 17th, 24th, 31st and 38th day. Immunohistochemical SABC method and image analysis were used to count the number of cells.
RESULTS: Compared with the NCG and SCG, the cell numbers of colon 5-HT, SS -IR cells were increased (F = 4.373, 5.708, both P < 0.01) during heroin dependence, and especially on the 31st day. The result of image analysis showed that the mean of grey degree of the colon 5-HT-, SS -IR cells declined in HCG as compared with the NCG and SCG (F = 38.637, 25.091, both P < 0.01). And in 5-HT-, SS-IR cells, the mean grey scales were the lowest on the 31st day.
CONCLUSION: During heroin dependence, endocrine cells of colon were involved in regulation of functional disorder in intestinal tract by enhancing synthesis and secretion of 5-HT and SS.
- Citation: Hong Y, Liang WM. Effect of heroin dependence on expression of 5-hydroxytryptamine and somatostatin in endocrine cells of rat colon. Shijie Huaren Xiaohua Zazhi 2009; 17(10): 976-980
- URL: https://www.wjgnet.com/1009-3079/full/v17/i10/976.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i10.976
海洛因滥用及成瘾的社会公害已众所周知. 国内外的研究资料表明, 海洛因成瘾后消化系统出现不同程度的功能紊乱[1-2]. 海洛因成瘾后对胃肠道的损害也引起国内外学者的广泛关注, 但有关结肠内分泌细胞在海洛因依赖期间形态学的变化尚未见报道. 本实验以海洛因成瘾大鼠为动物模型, 用免疫组织化学方法观察大鼠海洛因依赖期间结肠内5-HT、SS-IR细胞的数量及免疫反应强度的改变, 旨在为探讨海洛因成瘾机制提供形态学资料.
健康成年SD大鼠, 体质量180-220 g, 雌雄各半, 分笼喂养, 贵阳医学院实验动物中心提供. 海洛因纯度为61.48%, 由贵州省公安厅提供.
1.2.1 造模及分组: 按配对原则分为实验性海洛因依赖组(HDG)及盐水对照组(SDG)各30只, 正常对照组(NCG)6只. 海洛因依赖实验动物按已建立的方法制作: 依赖组按体质量逐日递增注射海洛因药液. 首日剂量为3 mg/kg, 每日2次(上午8时, 下午3时). 连续皮下注射9 d至成瘾, 第9天剂量为27 mg/kg, 成瘾后的大鼠每日上午8时皮下注射海洛因1次, 剂量27 mg/kg, 维持至取材. 盐水组按体质量每日注射与依赖组相同剂量的生理盐水, 正常组不予任何处理, 按时喂养.
1.2.2 取材及标本制备: 海洛因依赖组和盐水对照组大鼠于模型建立的第10、17、24、31、38天处死, 每次处死6只(雌雄各半), 正常对照组6只. 生理盐水灌洗, 取结肠中段组织, Bouin液固定, 常规石蜡包埋, 制成4 μm厚的连续切片.
1.2.3 免疫组织化学SABC法: 免疫组织化学SABC法, 分别显示5-HT、SS免疫反应细胞. 主要步骤为: 切片常规脱蜡至水, 100 g/L甲醛-H2O2 10 min, 正常山羊血清(1:50)封闭30 min, 依次滴加5-HT(1:200)或SS(1:100)抗血清(北京中杉金桥生物工程有限公司提供), 4 ℃过夜, 羊抗兔IgG(1:100)37 ℃孵育20 min, SABC复合物(1:100)37 ℃孵育20 min, DAB-H2O2液显色, 苏木精复染细胞核, 中性树胶封片. 方法对照: PBS缓冲液代替特异性抗血清, 余步骤同上.
1.2.4 图像分析: 随机选取第10、17、24、31、38天海洛因依赖组和盐水对照组大鼠结肠切片, 各时间点5张, 正常对照组5张. 在40×物镜下, 每张切片随机选取5个视野, 分别计数每个视野内有核阳性5-HT-IR、SS-IR细胞数. 同样的方法选取视野, 用BioMias图像分析系统检测5-HT-IR、SS-IR细胞的平均灰度值.
统计学处理 所得数据应用SPSS11.5统计软件进行单因素方差分析.
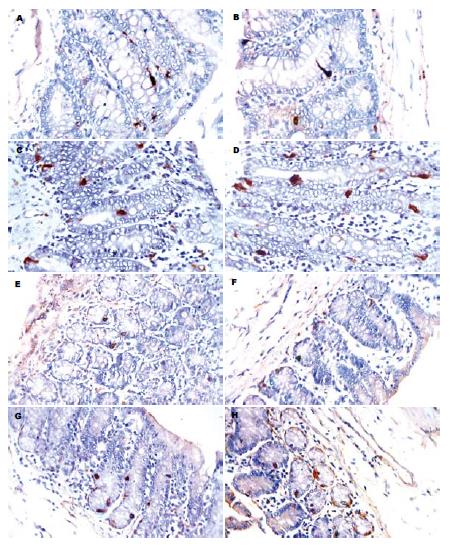
2.1.1 光镜观察: 结肠5-HT-IR细胞数量较多, 散在分布于上皮内. 免疫反应产物位于细胞的基底部, 染色较深, 呈棕褐色颗粒状, 方法对照切片未见免疫反应阳性细胞. 大鼠结肠内5-HT-IR细胞大小不等, 形态多样(图1A). 与正常对照组比较, 盐水对照组各时间点之间5-HT-IR细胞的数量、分布及染色强度均无明显差别(图1B). 海洛因依赖组各时间大鼠结肠5-HT-IR细胞数量明显增多, 免疫染色有所增强(图1C-D).
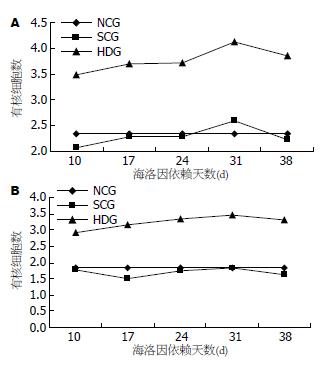
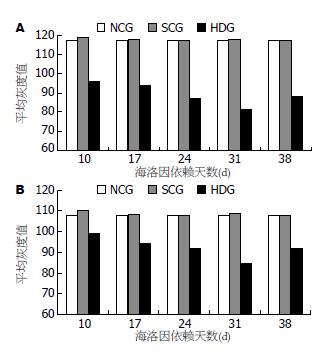
2.1.2 图像分析: 盐水对照组和正常对照组5-HT-IR细胞计数无明显差异(P>0.05), 盐水对照组各时间点之间5-HT-IR细胞计数的差异也无显著性(P>0.05). 与正常和盐水对照组比较, 海洛因依赖组5-HT-IR细胞的细胞计数明显增多, 以31 d最多(表1, 图2A). 正常及盐水对照组5-HT-IR细胞的平均灰度值无统计学意义(P>0.05), 盐水对照组各时间点之间5-HT-IR细胞的平均灰度值也无明显差别(P>0.05). 而海洛因依赖组5-HT-IR细胞的平均灰度值较空白和盐水对照组显著降低(P<0.05), 于31 d时达最低(表2, 图3A).
2.2.1 光镜观察: 光镜下, 大鼠结肠SS-IR细胞免疫反应产物呈棕黄色颗粒状, 定位于胞质内, 数量少, 散在分布于肠腺上皮细胞之间(图1E). 方法对照未见阳性反应细胞.
与正常对照组比较, 盐水对照组SS-IR细胞的形态、数量、分布及免疫染色强度均无明显差别, 盐水组各时间点之间也无差异(图1F). 海洛因依赖组大鼠结肠SS-IR细胞的形态和分布与盐水及空白对照组大致相同但细胞数增多, 细胞的免疫反应强度增强, 以31 d最强(图1G-H).
2.2.2 图像分析: 正常对照组与盐水对照组5-HT-IR细胞计数的差异无统计学意义(P>0.05). 盐水对照组各时间点之间5-HT-IR细胞计数的差异也无显著性(P>0.05). 而海洛因5-HT-IR细胞计数于10、17、24、31 d明显增多(P<0.05), 38 d有所下降(表3, 图2B).
正常对照组与盐水对照组5-HT-IR细胞的平均灰度值的差异无显著性(P>0.05). 盐水对照组各时间点之间5-HT-IR细胞平均灰度值的差异也无统计学意义. 海洛因依赖组5-HT-IR细胞的平均灰度值较空白和盐水对照组显著降低(P<0.05), 以31 d的平均灰度值最低(表4, 图3B).
内源性阿片肽是机体许多神经递质和激素的调控剂, 外源性阿片类药物可使内源性阿片肽系统受到抑制, 使阿片类药物依赖者体内众多的神经递质功能发生变化. 海洛因滥用对机体消化系统造成明显损害, 海洛因依赖者消化系溃疡、消化系出血、肠易激综合征等发病率呈增高趋势[1-2], 且与胃肠肽类激素的改变有关[2].
5-HT是一种在人体内广泛存在的生物活性胺, 哺乳动物体内大约60%-90%的5-HT存在于胃肠道, 主要由EC细胞合成. 5-HT作为一种神经递质, 对机体免疫系统和神经内分泌系统都有调节作用. 近年来, 5-HT对肠正常动力和分泌的调控作用越来越受到人们关注. 肠蠕动、分泌反射的激发, 首先依赖于肠黏膜EC细胞释放5-HT, 同时, 5-HT又是肠神经系统信号传递时重要的神经递质[3-5]. 愈来愈多的研究发现, 5-HT信号系统异常与胃肠道功能性疾病密切相关, 如慢性便秘、肠易激综合征、腹泻及功能性消化不良等[6-7]. 在慢性传输型便秘患者的结肠黏膜中, 5-HT阳性细胞的数量明显多于对照组[8]. 有关5-HT与阿片肽的关系, 有研究报道阿片类物质在中枢神经系统中通过各种直接或间接作用兴奋5-HT能神经元, 促进5-HT的合成和释放[9]. Sáiz et al研究证实5-HT(2A)受体基因的表达与海洛因依赖的形成具有相关性[10]. 本实验用免疫组织化学及图像分析所得的研究结果更直接反映结肠EC细胞在海洛因依赖过程中的动态变化, 从而为进一步探讨EC细胞参与机体对海洛因依赖的调节机制提供依据. 形态学观察发现海洛因依赖组大鼠结肠EC细胞内5-HT免疫反应强度增强, 细胞计数结果显示5-HT-IR细胞数量增多, 图像分析结果也表明5-HT-IR细胞的平均灰度值降低; 上述结果说明在海洛因依赖期间, 海洛因可能通过各种作用促进5-HT合成和分泌, 提示5-HT可能参与了海洛因依赖过程中肠道功能紊乱的调节过程.
生长抑素广泛分布于脑、肠道神经细胞及胃肠道D细胞, 是一种典型的脑肠肽. 目前证实生长抑素对机体的几乎所有生理性内外分泌反应均起抑制作用, 另外还抑制胃肠道运动及抑制细胞增殖等[11]. 凌东进 et al对重症急性胰腺炎的研究表明, 生长抑素对结肠黏膜机械屏障具有明显保护作用[12]. 待普罗芬(beta-casomorphin)-7对大鼠胃黏膜G、D细胞中调节肽的基因表达具有调节作用[13]. 另有报道指出, SS能激活鸦片受体, 而阿片肽通过作用于μ受体, 又可反馈抑制SS的释放, 表明SS与内源性阿片肽有密切关系[14]. 目前大多数学者认为阿片依赖是一种细胞适应性反应, 特别是机体各系统发生细胞及分子水平上的适应. 从而导致细胞的生理生化过程及组织结构的代偿性改变, 最终达到病理状态的平衡[15]. 本实验结果表明海洛因依赖期间, 大鼠结肠D细胞内SS的表达较正常及盐水对照组明显增高, 提示海洛因长期作用可能导致肠道细胞发生适应性反应, 使D细胞合成和分泌SS增多, 发挥其对肠黏膜保护作用, 从而对抗海洛因滥用造成的肠道功能损伤.
胃肠道已不仅是体内重要的消化器官, 也是体内最大的内分泌器官. 胃肠激素已构成机体调节系统中一个重要组成成分. 许多研究表明, 海洛因成瘾者消化系疾病的发病与胃肠肽类激素的改变密切相关. 然而, 在海洛因成瘾时机体结肠神经内分泌的形态学和机能学的改变及其关系的研究尚少, 形态学方面的研究尤其少见.
杜祥, 教授, 复旦大学附属肿瘤医院病理科
海洛因是目前非法滥用范围最广、危害程度最为严重的阿片类药物, 海洛因滥用及成瘾已成为当今世界范围内的社会公害, 国内外的研究资料表明, 海洛因成瘾后消化系统出现不同程度的功能紊乱, 研究发现, 阿片肽除本身直接作用于消化系引起胃肠道运动减弱或加强括约肌收缩或舒张和影响胃酸分泌外, 还对一些胃肠道肽类激素的分泌有调节作用, 可引起血浆胃动素浓度增高, 对VIP的释放具有持续的抑制作用.
有研究报道阿片类物质在中枢神经系统中通过各种直接或间接作用兴奋5-HT能神经元, 促进5-HT的合成和释放. Sáiz et al研究证实5-HT(2A)受体基因的表达与海洛因依赖的形成具有相关性. beta-casomorphin-7对大鼠胃黏膜G、D细胞中调节肽的基因表达具有调节作用. 目前大多数学者认为阿片依赖是一种细胞适应性反应, 特别是机体各系统发生细胞及分子水平上的适应. 从而导致细胞的生理生化过程及组织结构的代偿性改变, 最终达到病理状态的平衡.
本文的相关工作将为深入理解阿片类毒品依赖性形成机制提供重要的形态学依据. 并为临床通过调整体内激素、细胞因子、神经肽的水平来治疗海洛因成瘾者奠定理论基础.
本文选题较好, 研究设计合理, 结果可信, 结论可靠, 具有较好的学术价值.
编辑:李军亮 电编:何基才
| 1. | Thomas J. Opioid-induced bowel dysfunction. J Pain Symptom Manage. 2008;35:103-113. [PubMed] [DOI] |
| 3. | De Ponti F. Pharmacology of serotonin: what a clinician should know. Gut. 2004;53:1520-1535. [PubMed] [DOI] |
| 4. | Tonini M, Pace F. Drugs acting on serotonin receptors for the treatment of functional GI disorders. Dig Dis. 2006;24:59-69. [PubMed] [DOI] |
| 5. | Hansen MB. The enteric nervous system II: gastrointestinal functions. Pharmacol Toxicol. 2003;92:249-257. [PubMed] [DOI] |
| 7. | Gershon MD. Nerves, reflexes, and the enteric nervous system: pathogenesis of the irritable bowel syndrome. J Clin Gastroenterol. 2005;39:S184-S193. [PubMed] |
| 8. | Zhao RH, Baig MK, Mack J, Abramson S, Woodhouse S, Wexner SD. Altered serotonin immunoreactivities in the left colon of patients with colonic inertia. Colorectal Dis. 2002;4:56-60. [PubMed] [DOI] |
| 9. | Buydens-Branchey L, Branchey M, Fergeson P, Hudson J, McKernin C. Craving for cocaine in addicted users. Role of serotonergic mechanisms. Am J Addict. 1997;6:65-73. [PubMed] |
| 10. | Sáiz PA, García-Portilla MP, Arango C, Morales B, Martínez-Barrondo S, Alvarez C, San Narciso G, Carreño E, Alvarez V, Coto E. Association between heroin dependence and 5-HT2A receptor gene polymorphisms. Eur Addict Res. 2008;14:47-52. [PubMed] [DOI] |
| 11. | Panteris V, Karamanolis DG. The puzzle of somatostatin: action, receptors, analogues and therapy. Hepatogastroenterology. 2005;52:1771-1781. [PubMed] |
| 13. | Zong YF, Chen WH, Zhang YS, Zou SX. Effects of intra-gastric beta-casomorphin-7 on somatostatin and gastrin gene expression in rat gastric mucosa. World J Gastroenterol. 2007;13:2094-2099. [PubMed] |
| 14. | Ringel Y, Sperber AD, Drossman DA. Irritable bowel syndrome. Annu Rev Med. 2001;52:319-338. [PubMed] [DOI] |
| 15. | Koob GF, Le Moal M. Drug addiction, dysregulation of reward, and allostasis. Neuropsychopharmacology. 2001;24:97-129. [PubMed] [DOI] |