修回日期: 2008-03-10
接受日期: 2008-04-21
在线出版日期: 2008-04-28
目的: 探讨木疏胶囊抗大鼠肝纤维化的免疫作用机制.
方法: 400 g/L CCl4诱导大鼠肝纤维化模型. Wister大鼠随机分为正常对照组, 模型对照组, 木疏胶囊预防组和治疗组, 鳖甲软肝片预防组和治疗组. HE染色和Masson染色观察肝右叶相同部位组织病理改变. 放免法测定血清细胞因子IL-2、IL-6、IL-8及TNF-α, 流式细胞术检测血淋巴细胞CD4、CD8表达.
结果: 木疏胶囊与鳖甲软肝片各组两两比较, 对IL-2和IL-6作用均无显著性差异; 对IL-8的降低作用木疏胶囊优于鳖甲软肝片(预防组: 0.4±0.2 μg/L vs 0.6±0.1 μg/L; 治疗组: 0.5±0.2 μg/L vs 0.6±0.2 μg/L; 均P<0.05); 对TNF-α的降低作用为木疏胶囊预防组优于鳖甲软肝片(1.1±0.3 μg/L vs 1.4±0.3 μg/L, P<0.05), 而治疗组无显著差异. 与模型对照组比较, 木疏胶囊预防组和治疗组使CD4和CD4/CD8均显著升高(CD4: 36.4%±7.5%, 34.6%±5.0% vs 28.0%±5.1%; CD4/CD8: 1.9%±0.4%, 1.8%±0.3% vs 1.5%±0.2%; 均P<0.01), 鳖甲软肝片预防组使CD4显著升高(33.4%±4.9% vs 28.0%±5.1%, P<0.05), 治疗组无显著性差异, 鳖甲软肝片使CD8和CD4/CD8升高, 但均无显著性差异; 木疏胶囊和鳖甲软肝片对CD4、CD8、CD4/CD8的作用无显著性差异.
结论: 木疏胶囊可升高肝纤维化大鼠血清IL-2, 降低IL-6、IL-8和TNF-α水平, 升高CD4、CD4/CD8.
引文著录: 高萍, 程留芳, 刘春, 邵泽勇. 复方中药木疏胶囊抗大鼠肝纤维化的免疫机制. 世界华人消化杂志 2008; 16(12): 1266-1272
Revised: March 10, 2008
Accepted: April 21, 2008
Published online: April 28, 2008
AIM: To investigate the immunologic mechanism underlying the antifibrotic action of Mushu capsule in rats with hepatic fibrosis.
METHODS: A hepatic fibrosis model was induced by subcutaneous injection of carbon tetrachloride (CCl4). Wister rats were randomly divided into 4 groups: normal control group, model group, Mushu capsule (MC) group and Biejia Ruangan tablet (BRT) group. MC group and BRT group were subdivided into prevention group and treatment group. Liver sections were stained with HE and Masson respectively for pathological examination. Serum interleukin-2, -6, -8 (IL-2, 6, 8) and tumor necrosis factor-α (TNF-α) levels were determined by radioimmunoassay. The levels of CD4 and CD8 cells were measured by flow cytometry.
RESULTS: IL-2 and IL-6 levels were not obviously different between MC group and BRT group, but IL-8 level in MC groups was markedly lower than that in BRT groups (preventing group: 0.4 ± 0.2 mg/L vs 0.6 ± 0.1 mg/L; treatment group: 0.5 ± 0.2 mg/L vs 0.6 ± 0.2 mg/L, both P < 0.05). MC was superior to BRT in preventing serum TNF-α elevation (1.1 ± 0.3 mg/L vs 1.4 ± 0.3 mg/L, P < 0.05). The decreased serum CD4 and CD4/CD8 levels were markedly raised in MC preventing groups and treatment group (CD4: 36.4% ± 7.5%, 34.6% ± 5.0% vs 28.0% ± 5.1%; CD4/CD8: 1.9% ± 0.4%, 1.8% ± 0.3% vs 1.5% ± 0.2%, all P < 0.01) in comparison with those in model group. The decreased serum CD4 level was markedly raised in BRT preventing group (33.4% ± 4.9% vs 28.0% ± 5.1%, P < 0.05), while there was no difference in BRT treatment group. BRT up-regulated the levels of serum CD8 and CD4/CD8 cells without significant differences. The levels of CD4, CD8 and CD4/CD8 cells had no notable difference between MC group and BRT group.
CONCLUSION: Mushu capsule can regulate the humoral immunity in rats with liver fibrosis by elevating serum IL-2 and decreasing serum IL-6, IL-8 and TNF-α. Simultaneously, it can up-regulate the levels of CD4 and CD4/CD8.
- Citation: Gao P, Cheng LF, Liu C, Shao ZY. Immunologic mechanism in antifibrotic action of Mushu capsule in rats. Shijie Huaren Xiaohua Zazhi 2008; 16(12): 1266-1272
- URL: https://www.wjgnet.com/1009-3079/full/v16/i12/1266.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i12.1266
肝纤维化是慢性肝病向肝硬化发展的必经之路, 已有研究表明肝纤维化有可能发生逆转. 由于肝纤维化的发生发展与免疫状态有关, 我们从体液免疫和细胞免疫的角度研究木疏胶囊对实验性肝纤维化大鼠免疫功能的调节作用, 进一步探讨其抗纤维化机制.
同系Wister大鼠60只, 雌雄各半, 体质量200±20 g, 清洁级, 中国人民解放军总医院动物实验中心提供. 木疏胶囊为当归、黄芪、鳖甲、大枣、黑豆等, 由北京宝树堂科技药业有限公司精制而成胶囊. 鳖甲软肝片为鳖甲、三七、赤芍、冬虫夏草、连翘等, 中国人民解放军302医院研制, 内蒙古福瑞制药厂生产. CCl4分析纯北京化学试剂公司. IL-2、IL-6、IL-8、TNF-α放射免疫测定试剂盒由中国人民解放军总医院东亚放免所提供. FITC标记的大鼠CD4 mAb, PE标记的大鼠CD8 mAb由北京鼎国生物技术发展中心提供. N-695B型智能放免γ测量仪(北京海核所日环光电仪器有限公司). FACS Calibur流式细胞仪(美国Becton Dickson公司).
1.2.1 造模及分组: 根据人与大鼠药物剂量换算[1]本课题组前期实验研究成果[2]选用木疏胶囊每日3.125 g/kg, 鳖甲软肝片0.625 g/kg作为实验. 将CCl4分析纯40 mL溶于橄榄油60 mL中, 常温保存备用. 造模各组于实验第1天sc 400 mL/L CCl4 5 mL/kg, 以后每4天3 mL/kg, 连续8 wk. 各组均用普通饲料喂养, 自由饮水. Wister大鼠40只, 雌雄各半, 随机分为正常对照组(n = 10), 模型对照组(n = 10), 木疏胶囊预防组(n = 10), 鳖甲软肝片预防组(n = 10). 造模同时正常对照组及模型对照组蒸馏水5 mL/d, 分2次ig, 木疏胶囊预防组木疏胶囊3.125 g/kg溶于蒸馏水5 mL后, 每日分2次ig, 鳖甲软肝片预防组鳖甲软肝片0.625 g/kg溶于蒸馏水5 mL后, 每日分2次ig, 治疗4 wk. 另Wister大鼠40只, 雌雄各半, 随机分为正常对照组(n = 10), 模型对照组(n = 10), 木疏胶囊治疗组(n = 10), 鳖甲软肝片治疗组(n = 10). 造模结束后正常对照组及模型对照组蒸馏水5 mL/d, 分2次ig, 木疏胶囊治疗组木疏胶囊3.125 g/kg溶于蒸馏水5 mL后, 每日分2次ig, 鳖甲软肝片治疗组鳖甲软肝片0.625 g/kg溶于蒸馏水5 mL后, 每日分2次ig, 治疗4 wk.
1.2.2 血清细胞因子的测定: 心脏取血2 mL迅速注入肝素抗凝管(消毒配置好的商品化4 mL玻璃管), 即刻用于CD4、CD8检测[4], 其余3000 r/min, 25℃离心15 min, 留取血清用于IL-2、IL-6、IL-8及TNF-α等指标检测. 另用流式细胞术检测大鼠血T淋巴细胞亚群的影响.
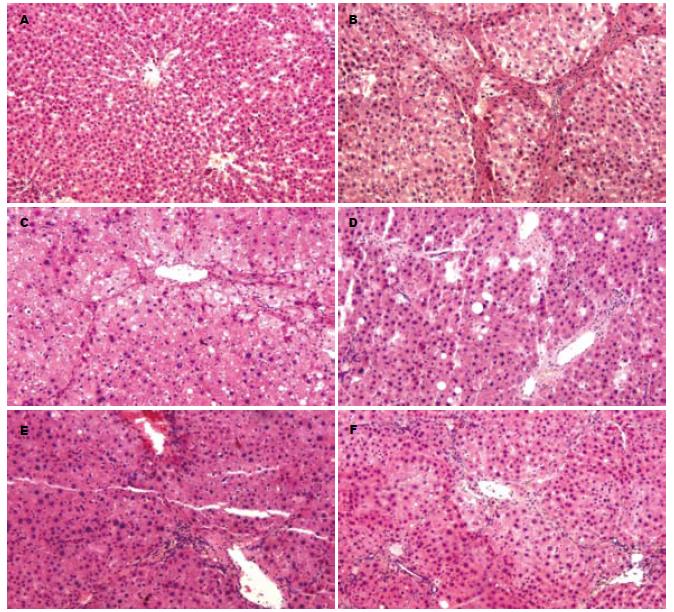
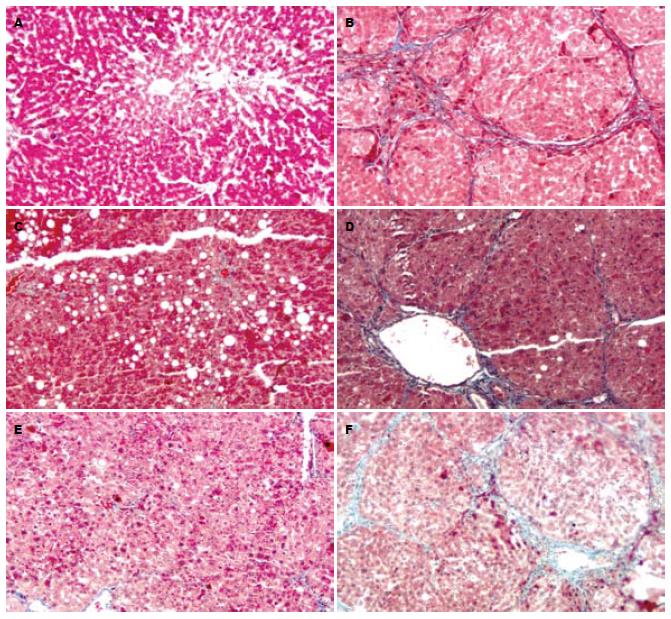
1.2.3 肝组织学观察: 取肝右叶相同部位组织固定于中性甲醛溶液中, 乙醇梯度脱水, 二甲苯透明、浸蜡包埋, 4-7 μm厚度连续切片用于HE, Masson染色行组织学观察和肝脏纤维组织定量测定. Masson染色, 片选取四周及中央5个区域, 取胶原纤维含量最多的视野, 用病理图像分析系统测定胶原面积百分比(胶原纤维面积/肝组织面积×100%), 取平均数作为判定肝纤维化程度的客观指标. HE染色片, 由资深病理医师阅片, 按文献[5]方法进行肝纤维化分级.
统计学处理 数据采用SPSS13.0统计软件包进行分析, 结果以mean±SD表示. 数值变量资料多组间比较采用方差分析, LSD法进行组间两两比较. P<0.05为具有显著性差异.
实验结束时, 正常对照组大鼠均存活良好. CCl4 sc 4 wk动物出现乏力、嗜睡、皮毛皱而不洁、进食减少、尿黄, 个别大鼠趾甲易出血, 鼻有出血. 造模结束时模型对照组大鼠皮毛松弛、杂乱、粗糙无光泽, 活动及食欲少、营养状况欠佳; 木疏胶囊及鳖甲软肝片预防组及治疗组大鼠皮毛松弛、无光泽, 营养状况一般. 实验结束时模型对照组大鼠死亡1只, 鳖甲软肝片预防组死亡1只, 木疏胶囊预防组大鼠死亡2只, 鳖甲软肝片治疗组死亡1只, 木疏胶囊治疗组大鼠无死亡.
肝组织病理切片HE和Masson染色观察, 正常对照组大鼠肝小叶结构完整, 肝索排列整齐, 汇管区无纤维化; 模型对照组造模后, 大鼠肝细胞浊肿, 肝小叶失去正常结构, 汇管区胶原沉积, 可见胶原纤维自中央静脉及汇管区向周围延伸, 形成较粗的纤维间隔, 有的已经有假小叶形成; 木疏胶囊预防组及鳖甲软肝片预防组肝小叶结构基本正常, 肝细胞无明显变性、坏死, 肝索排列相对整齐, 仅汇管区少量胶原沉积, 无明显纤维间隔形成; 木疏胶囊治疗组、鳖甲软肝片治疗组部分肝小叶结构排列仍紊乱, 肝细胞轻度脂肪变性, 汇管区有较多胶原纤维沉积(图1-2, 表1).
木疏胶囊对肝纤维化大鼠血清IL-2影响的结果为: 模型对照组与正常对照组比较, 下降有显著性差异; 各用药组与模型对照组比较, 升高均有显著性差异; 木疏胶囊预防组和治疗组分别与鳖甲软肝片预防组和治疗组进行两两比较, 对IL-2的升高作用均无显著性差异. 木疏胶囊对肝纤维化大鼠血清IL-6影响的结果为: 模型对照组与正常对照组比较, 升高有显著性差异; 各用药组与模型对照组比较, 下降均有显著性差异; 木疏胶囊各组与鳖甲软肝片各组进行两两比较, 对IL-6的降低作用相当, 均无显著性差异. 木疏胶囊对肝纤维化大鼠血清IL-8影响的结果为: 模型对照组与正常对照组比较, 升高有显著性差异; 各用药组与模型对照组比较, 下降均有显著性差异; 与鳖甲软肝片预防组和治疗组进行两两比较, 木疏胶囊预防组和治疗组对IL-8的升高作用均优于鳖甲软肝片, 均有显著性差异. 木疏胶囊对肝纤维化大鼠血清TNF-α影响的结果为: 模型对照组与正常对照组比较, 升高有显著性差异, 各用药组与模型对照组比较, 下降均有显著性差异, 与鳖甲软肝片预防组和治疗组进行两两比较, 木疏胶囊预防组对TNF-α的升高作用优于鳖甲软肝片预防组和治疗组, 而木疏胶囊治疗组与鳖甲软肝片预防组和治疗组对TNF-α的降低作用相当, 无统计学意义(表2).
模型对照组与空白对照组比较, 下降有显著性差异, 各用药组与模型对照组比较, 鳖甲软肝片治疗组升高没有显著性差异, 其余各组升高均有显著性差异, 木疏胶囊预防组和治疗组分别与鳖甲软肝片预防组和治疗组进行两两比较, 显示木疏胶囊与鳖甲软肝片使CD4升高的作用相当, 无显著性差异. 木疏胶囊对肝纤维化大鼠血清CD8影响的结果为: 模型对照组与空白对照组比较, 下降无显著性差异, 各用药组与模型对照组比较及木疏胶囊预防组和治疗组与鳖甲软肝片预防组和治疗组之间两两比较, 对CD8的升高作用均无显著性差异. 木疏胶囊对肝纤维化大鼠血清CD4/CD8影响的结果为: 模型对照组与空白对照组比较, 降低有显著性差异, 鳖甲软肝片治疗组与空白对照组比较, 降低也有显著性差异, 各用药组与模型对照组比较, 木疏胶囊预防组和治疗组CD4/CD8升高均有显著性差异, 与鳖甲软肝片预防组和治疗组进行两两比较, 木疏胶囊预防组和治疗组与鳖甲软肝片对CD4/CD8的升高作用相当, 无显著性差异(表3).
木疏胶囊在益气养血的同时, 根据辨证论治, 注重活血化瘀, 兼顾扶正、补虚、利湿等, 前期实验已证实能有效干预大鼠肝纤维化及其部分机制. 肝脏是产生细胞因子主要场所之一, 细胞因子又影响着肝脏受化学及感染等损伤的修复过程, IL-2、IL-6、IL-8和TNF-α是一组由单核巨噬细胞、内皮细胞产生的细胞因子, 具有激活诱导T或B细胞分化, 增强NK细胞杀伤靶细胞, 促进吞噬等功能, 广泛参与生物调节和免疫应答过程, 是机体炎症反应和一系列病理生理过程的重要介质. IL-2具有激活免疫效应细胞和产生协同效应因子的作用, 能有效的清除肿瘤细胞和病毒细菌感染细胞, 其产生和表达异常与临床疾病有密切关系, 所以通过外周血IL-2测定, 可以反映疾病变化[6]. 木疏胶囊及鳖甲软肝片预防组和治疗组均可使血清IL-2水平升高, 提示其抗肝纤维化作用可能与此有关. IL-6与肝脏疾病的关系密切. 又称肝细胞刺激因子(hepatocyte stimulating factor, HSF), 肝细胞表面有其高亲和力受体. Hanada et al[7]研究发现正常大鼠FSC能表达IL-6 mRNA和分泌有生物活性的IL-6, 并通过自分泌机制促进其自身转化为肌纤维母细胞. Migita et al[8]对77例HCVAb+的肝硬化患者进行血清IL-6水平的测定, 发现其明显高于对照组(P<0.05), 提示IL-6刺激和维持肝纤维化. 这些证据均提示, IL-6作为一种炎性细胞因子, 介导肝脏炎症反应, 从而刺激肝纤维化的发生, 这一点是肯定的. 本研究中肝纤维化大鼠血清IL-6水平明显升高也说明IL-6与肝纤维化密切相关, 木疏胶囊预防组和治疗组大鼠血清IL-6水平均明显下降, 与模型组比较有统计学意义(P<0.01), 我们认为木疏胶囊可能通过降低血清IL-6水平, 减轻IL-6对肝脏炎症反应的介导, 对储脂细胞的激活, 降低IL-6刺激和维持肝纤维化的作用, 从而发挥抗肝纤维化作用, 但木疏胶囊与鳖甲软肝片作用相当.
英国学者Swiatkowska-Stodulska et al[9]对酒精性肝病患者的血清及肝组织检测发现IL-8在两者中水平皆增高. 研究还发现, 肝炎后肝硬变患者的血浆IL-8水平亦升高, 且与肝细胞恶性变相关[10]. 本研究中肝纤维化大鼠血清IL-8水平明显升高, 与文献报道一致. IL-8在肝硬化过程中, 可能通过细胞因子的瀑布效应, 促进胶原、纤维连接素等的合成, 形成肝纤维化及肝硬化[11]. 本研究中木疏胶囊治疗后肝纤维化大鼠血清IL-8水平明显下降, 我们认为木疏胶囊抗肝纤维化作用机制可能与IL-8有关, 通过降低IL-8水平, 减轻肝脏炎症反应, 减少肝细胞损害, 阻断肝纤维化过程中细胞因子的瀑布效应, 从而延缓肝纤维化的进展. 且木疏胶囊降低IL-8的作用优于鳖甲软肝片.
TNF-α异常分泌可作为机体炎症, 损伤及休克的重要介质, 在体内细胞因子网络中发挥重要调节作用, 他的增加可引起IL-1、IL-2、IL-6、IL-8、IFN等多种细胞因子的水平变化, 使细胞因子网络失衡而导致机体发生病理生理变化. Wang et al[12]对肝纤维化的形成进行了动态研究, 发现纤维化早期肝组织内首先出现TNF-α mRNA水平上升, 随后出现Ⅰ型胶原mRNA水平增高, 到肝纤维化晚期, 后者继续升高, 前者则出现下降, 木疏胶囊预防组和治疗组均可降低肝纤维化大鼠血清TNF-α水平, 提示木疏胶囊可能通过降低肝纤维化大鼠TNF-α水平, 而减小TNF-α对肝脏的毒性, 减轻肝细胞损伤, 减少其在肝脏炎症反应和肝纤维化中的作用, 认为木疏胶囊抗肝纤维化的机制可能与此有关, 且木疏胶囊预防组与鳖甲软肝片预防组和治疗组比较有显著性差异(P<0.05), 效果优于鳖甲软肝片, 而木疏胶囊治疗组与鳖甲软肝片预防组和治疗组比较, 仅有轻度降低, 差异均无统计学意义, 认为木疏胶囊治疗组降低TNF-α的作用与鳖甲软肝片相当, 可能与TNF-α在肝纤维化发生早期升高显著, 而晚期时已呈下降趋势, 治疗效果表现不及早期时表现明显.
外周的T细胞大部分是免疫成熟的CD4+ T细胞和CD8+ T细胞, 不同亚群的T淋巴细胞具有各自的潜在功能, 他们在外周血中的数量和比例的变化能够反映机体的病理生理状况. CD4+细胞的数量和功能下降, 直接导致细胞免疫功能低下. CD8+细胞毒性T细胞对清除感染的肝细胞, 清除病毒感染有重要作用, 其产生依赖 CD4+淋巴细胞的存在. Urbani et al[13]对急性自限性HBV感染患者与HBV持续感染患者外周血CD4+ T细胞及CD8+ T细胞反应进行比较分析, 结果显示, CD4+ T细胞功能下降及CD8+ T细胞反应下调与HBV感染持续有关. 肖光明 et al[14]研究显示慢性肝炎、肝炎肝硬变、慢性重型肝炎外周血CD4+、CD8+细胞绝对计数和CD4+/CD+比值均低于正常对照组和急性肝炎患者, 肝硬变患者细胞免疫功能的明显下降, 是临床上肝硬变易发展为肝癌和易并发感染的重要因素之一. 本研究中肝纤维化大鼠外周血中CD4+ T细胞明显下降, CD8无明显下降, 但P值为0.052, 接近具有显著性差异的临界值0.05, 可能由于样本量小所致, 提示应扩大样本量进行进一步研究, CD4/CD8同时下降, 与文献报道基本一致, 也反映了肝纤维化大鼠细胞免疫功能下降, 木疏胶囊预防组和治疗组CD4、CD4/CD8均升高, 有统计学意义(P<0.05), 故认为木疏胶囊对肝纤维化大鼠的细胞免疫功能紊乱可能有一定的调节作用, 并因此而发挥抗肝纤维化作用.
肝纤维化是慢性肝病向肝硬化发展的必经之路, 已有研究表明肝纤维化有可能发生逆转. 木疏胶囊能明显改善肝纤维化大鼠的肝功能,预防治疗可降低血清纤维化相关酶, 显著改善肝组织病理学损害, 有效地干预大鼠肝纤维化.
同行评价者
党双锁, 副教授, 西安交通大学第二医院感染科.
已有研究利用检测肝组织内的细胞因子如TGF-β1 mRNA与Ⅰ型前胶原mRNA的水平, 来判断肝纤维化的程度, 也有用IFN-γ及其他的抗肝纤维化药物治疗肝纤维化, 测定细胞因子判断药物疗效, 均获得满意效果. 细胞因子的研究, 对肝纤维化的防治具有广阔的前景和重要意义.
本课题组前期研究证实, 木苏丸治疗有促进蛋白合成, 改善肝功能作用. 干预治疗可以改善大鼠肝纤维化程度, 具有延缓及逆转实验性肝纤维化形成的作用.
本研究从体液免疫和细胞免疫的角度研究木疏胶囊对实验性肝纤维化大鼠免疫功能的调节作用, 进一步探讨其抗纤维化机制.
木疏胶囊可使肝纤维化大鼠血清IL-2升高, IL-6、IL-8、TNF-α水平降低, 对肝纤维化大鼠体液免疫功能有一定的调节作用.
本研究方法先进可行, 结果可信, 尤其在免疫调节方面研究肝纤维化发生发展有一定的参考意义.
编辑:李军亮 电编:吴鹏朕
| 2. | 高 峰, 程 留芳, 王 志强, 杨 云生. 木苏丸对大鼠二甲基亚硝胺肝纤维化肝组织TIMP-1, MMP-2 mRNA表达的作用. 世界华人消化杂志. 2005;13:355-357. [PubMed] |
| 3. | 丁 里玉, 刘 殿武, 贺 宇彤. 硒强化软肝胶囊对大鼠实验性肝纤维化的治疗作用. 中国中医基础医学杂志. 2004;10:23-25. |
| 4. | 刘 栋, 刘 志红. 流式细胞术检测人外周血CD4、CD8T淋巴细胞方法的建立. 肾脏病与透析肾移植杂志. 1998;7:400-401. |
| 7. | Hanada H, Ikeda-Dantsuji Y, Naito M, Nagayama A. Infection of human fibroblast-like synovial cells with Chlamydia trachomatis results in persistent infection and interleukin-6 production. Microb Pathog. 2003;34:57-63. [PubMed] [DOI] |
| 8. | Migita K, Abiru S, Maeda Y, Daikoku M, Ohata K, Nakamura M, Komori A, Yano K, Yatsuhashi H, Eguchi K. Serum levels of interleukin-6 and its soluble receptors in patients with hepatitis C virus infection. Hum Immunol. 2006;67:27-32. [PubMed] [DOI] |
| 9. | Swiatkowska-Stodulska R, Bakowska A, Drobinska-Jurowiecka A. Interleukin-8 in the blood serum of patients with alcoholic liver disease. Med Sci Monit. 2006;12:CR215-CR220. [PubMed] |
| 10. | Tachibana Y, Nakamoto Y, Mukaida N, Kaneko S. Intrahepatic interleukin-8 production during disease progression of chronic hepatitis C. Cancer Lett. 2007;251:36-42. [PubMed] [DOI] |
| 11. | Koivisto H, Hietala J, Niemela O. An inverse relationship between markers of fibrogenesis and collagen degradation in patients with or without alcoholic liver disease. Am J Gastroenterol. 2007;102:773-779. [PubMed] [DOI] |
| 12. | Wang X, Chen YX, Xu CF, Zhao GN, Huang YX, Wang QL. Relationship between tumor necrosis factor-alphaand liver fibrosis. World J Gastroenterol. 1998;4:18. [PubMed] |
| 13. | Urbani S, Boni C, Amadei B, Fisicaro P, Cerioni S, Valli MA, Missale G, Ferrari C. Acute phase HBV-specific T cell responses associated with HBV persistence after HBV/HCV coinfection. Hepatology. 2005;41:826-831. [PubMed] [DOI] |