修回日期: 2006-05-27
接受日期: 2006-06-05
在线出版日期: 2006-08-18
目的: 应用2-乙酰氨基芴(2-acetaminofluorene, 2-AAF), 研究L02细胞移植到具有正常免疫性的大鼠肝内的存活与增殖情况.
方法: SD大鼠出生前宫内ip正常人L02肝细胞, 诱导胎鼠对L02肝细胞产生免疫耐受, 出生2 wk时分别ip小(1.2 mg/kg)、中(13 mg/kg)、大剂量(30 mg/kg)2-乙酰氨基芴或生理盐水, 隔日行2/3肝切除术, 同时经脾移植DiI染色后的人L02肝细胞, 建立2-AAF/PH肝细胞增殖模型. 采用免疫荧光、RT-PCR、免疫组化、DiI荧光示踪等方法, 在不同时相分别检测人白蛋白、人白蛋白mRNA、增殖细胞核抗原(PCNA)以及在荧光显微镜下观察人L02肝细胞在鼠肝内的分布, 并采用计算机图像分析系统分析不同时相PCNA阳性细胞的数密度和面积密度.
结果: 2-乙酰氨基芴实验组(小、中、大剂量)的各项检测, 均与对照组无明显区别; 于移植后1, 2, 4, 6, 8, 10 wk在荧光显微镜下观察到人L02肝细胞在鼠肝内的动态分布; 移植后2, 4, 6, 8 wk大鼠均检测出人白蛋白及人白蛋白mRNA; 移植后2, 4, 6 wk检测出特异性人增殖细胞核抗原PCNA, 移植后1, 2, 4, 6, 8 wk检测出非特异性PCNA.
结论: 2-AAF/PH模型中, 2-乙酰氨基芴对移植L02细胞无明显增殖作用; L02细胞在2-乙酰氨基芴处理人鼠嵌合肝动物模型中存活10 wk, 产生白蛋白功能持续8 wk.
引文著录: 林沪, 毛青, 王宇明, 蒋业贵, 邓国宏, 蒋黎, 李俊刚, 刘国栋. L02细胞在2-乙酰氨基芴处理大鼠肝中的增殖. 世界华人消化杂志 2006; 14(23): 2281-2287
Revised: May 27, 2006
Accepted: June 5, 2006
Published online: August 18, 2006
AIM: To investigate whether human L02 hepatocytes can repopulate after implantation to the normal, immunocompetent rats treated with 2-acetaminofluorene.
METHODS: Human L02 hepatocytes were injected into the peritoneal cavities of fetal Sprague Dawley rats to induce immune tolerance. The 2-week rats were injected with different doses of 2-acetaminofluorene or normal saline, and received partial hepatoectomy. After 1, 1′-Dioctadecyl-3, 3, 3′, 3′-tetramethylindocarbocyanine perchlorate (DiI) staining, the hepatocytes were implanted to the 3-week rats via the spleen. Immuno-fluorescent staining, reverse transcription-polymerase chain reaction (RT-PCR), S-P immunohistochemistry, and DiI staining were used to detect human albumin, human albumin mRNA and specific proliferating cell nuclear antigen (PCNA) in the rat liver. The distribution of human L02 hepatocytes was observed under fluorescent microscope. The number and area density of PCNA-positive cells were quantified with the help of computer-assisted imgine analyzer.
RESULTS: All the examined indicators were not significantly different between the rats treated with 2-acetaminofluorene and normal saline. Dynamic distribution of human L02 hepatocytes in the rat livers was observed from wk 1 to 10 after implantation. Human albumin and human albumin mRNA were detected from wk 2 to 8 after implantation and the peak content appeared at the 4th wk. Specific human PCNA was detected in the rat livers from wk 2 to 6 after implantation. There were the most PCNA-positive cells at the 4th wk. Nonspecific PCNA was detected in the rat livers from wk 1 to 8 after implantation.
CONCLUSION: Human L02 hepatocytes can not significantly repopulate after implantation to the normal, immunocompetent rats treated with 2-acetaminofluorene. Human L02 hepatocytes can survive for 10 wk after implantation, and exhibit unique hepatic biochemical functions for 8 wk.
- Citation: Lin H, Mao Q, Wang YM, Jiang YG, Deng GH, Jiang L, Li JG, Liu GD. Repopulation of human L02 hepatocytes in tolerant rats treated with 2-acetaminofluorene. Shijie Huaren Xiaohua Zazhi 2006; 14(23): 2281-2287
- URL: https://www.wjgnet.com/1009-3079/full/v14/i23/2281.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v14.i23.2281
移植细胞在受体肝内的增殖是其存活及发挥功能的关键, 必须提高移植细胞的增殖能力, 才能建立稳定持久的人鼠嵌合肝动物模型[1]. 研究认为, 移植细胞要大量增殖, 必须满足2个条件: 移植肝细胞有更强的生长优势; 受体细胞的更新必须超过正常肝细胞更新水平, 二者相辅相存的[2]. 前者常用肝脏毒性药物: 倒千里光碱等生物碱、2-乙酰氨基芴(2-AAF)、dipin、呋喃(furan)、丝裂霉素、DDC (3'5-diethoxycarbonyl-1, 4-dihydrocollidine)、烯丙醇、甲基亚硝基氨(DEN)等[3-6], 可阻断受体肝细胞进入再生周期; 后者常采用四氯化碳、2/3肝切除(partial hepatoectomy, PH)等[7-8]再生刺激作用, 二者共同促进移植肝细胞增殖.
2-AAF与PH联合, 即卵圆细胞活化的基本模型[9], 目前国内外多用2-AAF抑制肝细胞的增殖, 在肝细胞再生需求下, 促进卵圆细胞的活化, 但是否能促进人鼠嵌合肝中移植细胞的增殖却少有报道. 我们将诱导免疫耐受的大鼠首先ip 2-AAF, 2 wk后行PH, 同时经脾移植DiI染色后的L02细胞, 建立2-AAF/PH肝细胞增殖模型; 采用免疫荧光、RT-PCR、免疫组化、DiI荧光示踪以及计算机图像分析系统等方法, 检测嵌合于具有正常免疫活性大鼠肝内人L02细胞的存活、增殖情况.
生育期SD大鼠6只, 购自第三军医大学实验动物中心. 选择大鼠孕龄15-17 d, 体质量250-300 g者为实验对象. L02细胞属于人正常肝细胞, 购自中国科学院上海细胞生物学研究所. 加入胰酶酶解后, 1100 r/min, 离心3 min, 重新混悬. 血细胞计数板计算肝细胞的数量, 台盼蓝拒染法计算存活率, 超过80%的用于实验.
诱导胎鼠免疫耐受: 对孕龄15-17 d的6只SD大鼠进行乙醚吸入麻醉. 自孕鼠腹白线逐层依次剪开, 暴露子宫. 用1 mL注射器将50 μL人L02细胞培养液(含1×108个细胞)缓慢经孕鼠子宫壁注射到胎鼠腹腔内, 缝合腹腔. 至孕鼠自然生产. 药物配制: 2-AAF用M400的聚乙二醇溶解, 该溶剂毒性小. 实验分组与药物注射: 6只SD孕鼠共产胎鼠约60只, 均分为实验组和对照组大鼠. 实验组免疫耐受胎鼠, 出生2 wk腹腔内注射2-AAF, 分小(1.2 mg/kg)、中(13 mg/kg)、大剂量组(30 mg/kg), 各分配约10只, 考虑到2-AAF对肝细胞的抑制有累积剂量依赖性[10], 分别按小剂量组每日连续注射, 共7针; 中、大剂量组隔日注射, 共4针. 对照组免疫耐受鼠, 出生2 wk ip生理盐水, 其余与药物组同. 实验组与对照组于注射结束后第2天, 乙醚麻醉下行PH并经脾移植DiI染色的L02肝细胞培养液100 μL (1×1012/L). PH: 大鼠在乙醚吸入麻醉下. 自腹白线暴露肝脏, 用细丝线分别结扎左前叶、右前叶、右后叶及尾叶后切除, 保留肝中叶, 腹腔青霉素抗炎. DiI荧光染色: 具体方法见文献[11], 标记细胞经4 g/L台盼蓝染色计数后, 用PBS液调整细胞浓度为1.0×1012/L; 于荧光显微镜诺丹明滤片下进行荧光观察并照相后送移植. L02细胞移植: 出生2 wk的实验组胎鼠, 乙醚吸入麻醉, 自孕鼠腹白线逐层剪开, 暴露脾, 自脾系膜缘进针, 向脾体和脾尾方向, 将100 μL经DiI染色的L02细胞培养液缓慢注入, 轻压注射点, 防止出血和渗液. L02细胞移植后1 wk取标本, 2 wk开始每2 wk取1次标本, 至10 wk结束, 每次每组取4只大鼠收集标本. 大鼠在乙醚吸入麻醉下行肝部分切除术, 新鲜肝组织送冰冻切片, 在荧光显微镜诺丹明滤片下观察; 部分组织用40 g/L中性甲醛固定, 石蜡包埋切片. 术后大鼠继续喂养. 用DiI染色L02肝细胞后, 移植前于荧光显微镜诺丹明滤片下观察; L02细胞移植后, 大鼠取新鲜肝组织送冰冻切片, 在荧光显微镜下观察.
1.2.1 免疫荧光检测肝组织人白蛋白: 采用链霉菌亲生物素蛋白-过氧化酶法(strept avidin-biotin immunostaining, SP)免疫组织化学染色(中山公司PV-6002试剂盒). 新鲜肝组织用冰冻切片4-8 μm, 室温放置30 min后, 入4 ℃丙酮固定10 min, 37 ℃下100 mL/L封闭血清孵育20 min, 滴加鼠抗人白蛋白mAb(Sigma公司, 滴度1:400), 37 ℃孵育60 min或4 ℃过夜, 加荧光标记二抗, 异硫氰酸荧光素(fluorescein isothiocyanate, FITC)标记山羊抗大鼠IgG(滴度1:100), 37 ℃暗室下孵育45 min. 用900 mL/L缓冲甘油封片, 荧光显微镜下用蓝色滤光片观察. PBS替代一抗作阴性对照.
1.2.2 检测肝组织特异性人PCNA: 采用SP免疫组织化学染色. 新鲜肝组织用40 g/L中性甲醛固定, 石蜡包埋后切片, 60 ℃烤箱中烤1-2 h, 脱蜡至水, 加入含0.5 g/L的Triton×100的PBS, 室温下孵育5 min, 37 ℃下30 mL/L过氧化氢孵育20 min, 特异性人PCNA mAb (Chemicon公司, 滴度1:200)或非特异性PCNA mAb(滴度1:200, 检测所有脊椎动物)4 ℃过夜, 然后加聚合物辅助剂和辣根酶标记羊抗鼠IgG多聚体. 底物用DAB显色, 苏木素复染, 中性树胶封片, 光镜下观察. PBS替代一抗作阴性对照. 采用LeicaQWin计算机图像分析系统, 在100倍PCNA免疫组化切片下, 每个切片随机选取5个测量区域, 计算在不同时相PCNA阳性细胞的数密度(个/μm2)和面积密度(μm2/μm2).
1.2.3 RT-PCR检测鼠肝组织人白蛋白mRNA: 按Trizol提取RNA试剂说明进行, 采用BioDev公司RT-PCR试剂盒的两步法逆转录和扩增反应, 引物由大连Takara公司设计合成. 人白蛋白mRNA引物, 正向引物Hs: 5'-TCGACAACGGCTCCGGCAT-3', 逆向引物Ha: 5'-AAGGTGTGGTGCCAGATTTTC-3', 扩增目的片段为241 bp; 正常大鼠白蛋白mRNA引物, 正向引物Rs: 5'-CGGTTTAGGGACTTAGGAGAACAGC-3', 逆向引物Ra: 5'-ATAGTGTCCCAGAAAGCTGGTAGGG-3', 扩增目的片段为388 bp. 扩增条件: 94 ℃预变性5 min, 94 ℃变性50 s; 55 ℃退火50 s; 72 ℃延伸1 min; 共32个循环, 最后72 ℃延伸8 min. 采用未加入AMV反转录酶的扩增作为阴性对照以排除假阳性的可能. 产物经15 g/L琼脂糖凝胶电泳, 溴化乙锭染色后于凝胶成像仪上获取图像.
统计学处理 数据均以mean±SD表示, 采用SPSS 10.0统计分析软件, 两均数的比较采用配对t检验.
由于实验鼠太小, 无法活体取肝组织且不易继续喂养, 故在实验鼠出生2 wk时经脾移植L02细胞. 实验组1只大鼠因麻醉过量死亡; 对照组2只大鼠因麻醉过量死亡. 从未纳入实验和对照组的胎鼠中选取, 继续给药实验. 其余大鼠营养及生长状况良好.
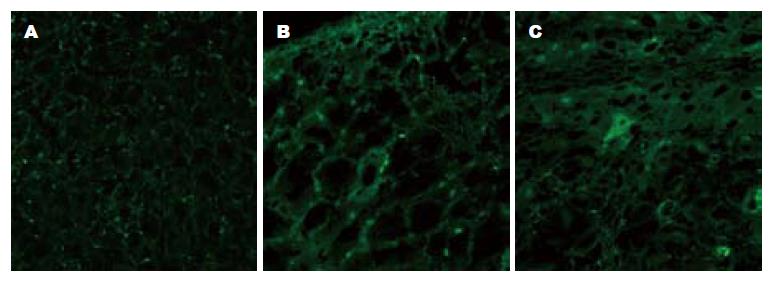
DiI染色的阳性细胞在绿色滤光片下显示红色荧光. 细胞均匀着色呈圆形或椭圆形, 不能区分胞核与胞质. 3种剂量实验组和对照组未见明显区别. 实验组或对照组的4只实验大鼠1, 2, 4, 6, 8 wk均可检测出, 10 wk每组有2至3只大鼠仍可见较微弱的荧光细胞, 其他1至2只为阴性, 每组4只大鼠12 wk均未再检出. 早期时相L02细胞分布在受体鼠肝内的门静脉区域, 聚集成团分布, 以后逐渐扩散到肝实质区域. 荧光细胞数目逐渐减少, 亮度逐渐减弱, 维持10 wk左右, 最后留下细胞核呈现点状荧光, 逐渐消失. 移植后1 wk的DiI荧光显示: 荧光染色区域较多, 有的区域密集分布, 荧光亮度大, 提示移植的L02肝细胞较多, 说明刚从脾转移到肝的L02细胞尚未弥散; 有的区域散在分布, 提示移植的L02肝细胞相对较少. 移植后2 wk和4 wk的DiI荧光显示: 荧光染色区域较多, 未见密集分布, 可见荧光散在分布, 说明从脾转移到肝的L02细胞已逐渐弥散分布. 移植后8 wk的DiI荧光显示: 荧光细胞较少, 可见少量荧光点状分布, 荧光亮度明显减弱(图1).
FITC标记荧光二抗, 阳性细胞在蓝色滤光片下显示为绿色荧光, 与周围大鼠肝细胞界限清楚, 胞核未着色. 3种剂量实验组和对照组未见明显区别. 移植L02细胞后2 wk的大鼠肝组织中即能检测到合成人白蛋白的L02细胞; 实验组的4只实验大鼠2, 4, 6 wk均可检测出合成人白蛋白的L02细胞, 以4 wk发现绿色荧光细胞最多; 8 wk有3只大鼠可见绿色荧光细胞, 1只为阴性, 4只大鼠10 wk均未再检出(图2).
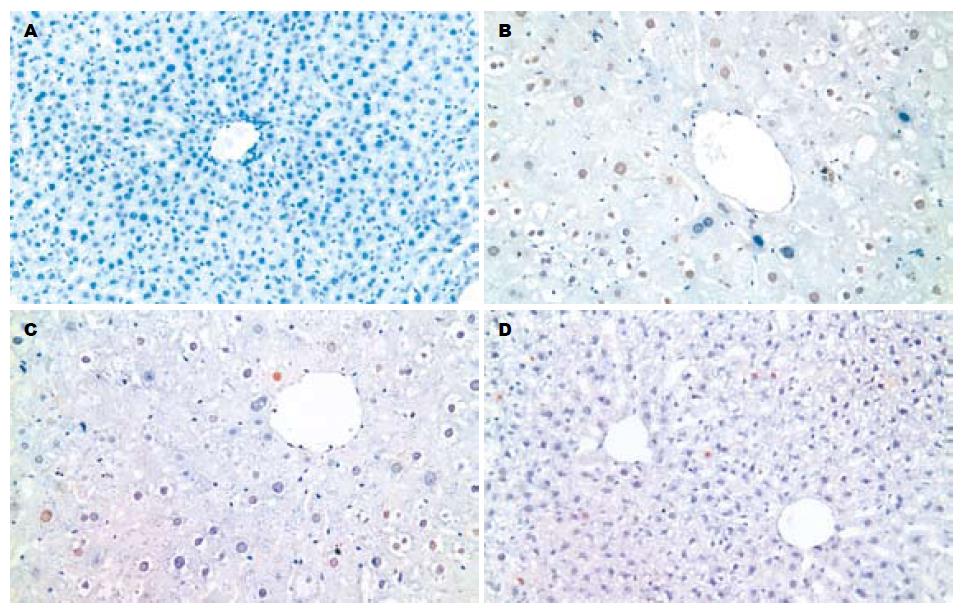
实验组和对照组各取两份切片, 分组为: 实验组1: 一抗为特异性人PCNA mAb. 特异性人PCNA阳性的细胞核, DAB显色后均为棕色, 其实验组和对照组无区别. 移植L02细胞后1 wk的大鼠肝组织中未能检测到特异性人PCNA; 2 wk才能检测到特异性人PCNA; 每组4只实验大鼠2, 4, 6 wk均可连续检测出特异性人PCNA, 以4 wk发现PCNA阳性细胞最多, 4只大鼠8 wk均未再检出. 实验组2: 一抗为非特异性PCNA mAb. 非特异性PCNA阳性的细胞核, DAB显色后亦为棕色, 其实验组和对照组亦无区别. 移植L02细胞后1 wk的大鼠肝组织中即能检测到特异性人PCNA; 每组4只实验大鼠1, 2, 4, 6, 8 wk均可连续检测出大量非特异性人PCNA(图3). PCNA的细胞图像分析, 实验组1与对照组1比较无统计学差异(P>0.05), 实验组2与对照组2比较无统计学差异(P>0.05, 表1).
| 分组 | 1 wk | 2 wk | 4 wk | 6 wk | 8 wk | |
| 数密度(10-4个/μm2) | 实验组1 | 0.14±0.03 | 0.43±0.04 | 0.26±0.08 | ||
| 对照组1 | 0.12±0.06 | 0.52±0.07 | 0.11±0.03 | |||
| 实验组2 | 6.26±1.07 | 5.79±0.75 | 6.32±0.84 | 7.58±1.17 | 5.18±1.03 | |
| 对照组2 | 5.17±1.05 | 7.42±1.22 | 5.86±1.12 | 4.46±1.03 | 6.33±0.75 | |
| 面积密度(10-4 μm2/μm2) | 实验组1 | 1.58±0.27 | 2.36±0.26 | 1.17±0.22 | ||
| 对照组1 | 1.38±0.47 | 2.25±0.33 | 1.74±0.46 | |||
| 实验组2 | 54.6±2.56 | 49.9±3.37 | 52.7±4.46 | 47.5±3.58 | 51.4±3.27 | |
| 对照组2 | 52.6±1.73 | 67.2±2.34 | 62.8±1.83 | 55.2±1.47 | 68.3±1.73 |
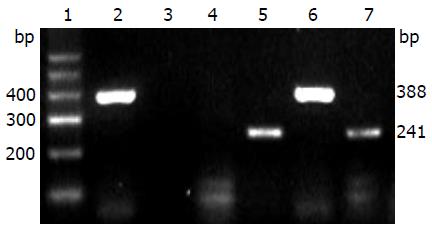
实验组和对照组均于移植后2, 4, 6, 8 wk检测出人白蛋白mRNA. 分别采用人和大鼠白蛋白mRNA引物作RT-PCR时, 可在实验大鼠肝组织中检测到相应的人白蛋白mRNA条带(241 bp)及大鼠白蛋白mRNA条带(388 bp)(图4).
肝细胞脾内植入后, 50%-65%随门脉血流迁移到受体肝窦, 但其中大约70%被门静脉血内的巨噬细胞清除, 残留的移植肝细胞在穿过肝窦内皮层时失去其细胞膜缝隙连接, 这些细胞合成血管内皮生长因子及获得细胞膜再生[12], 在移植5 d后可观察到移植的肝细胞与宿主肝细胞间的缝隙连接及胆管样结构的重构, 意味着移植细胞成功整合需要5 d以上[13-14]. 移植肝细胞与宿主肝整合后, 才可表达出白蛋白、胆汁的代谢和酶等功能. 我们在1 wk未能测出人白蛋白及特异性人PCNA, 而荧光示踪可见阳性, 提示移植L02细胞虽已转移并整合至鼠肝内, 但尚未具备合成白蛋白和增殖的功能. 肝细胞的主要功能之一是合成白蛋白, 所以白蛋白的合成是判断肝细胞功能非常敏感的指标, 其含量与有功能的肝细胞数量成正比. 许多研究将其作为衡量成熟肝细胞数量的指标[15]. 我们采用免疫荧光技术和RT-PCR, 从移植后2, 4, 6, 8 wk嵌合肝大鼠肝组织中检测出人白蛋白和人白蛋白mRNA, 证明L02细胞不仅在大鼠肝组织中存活, 而且具有正常人肝细胞一定的生物学功能. 既往研究表明, 肝细胞移植后的免疫排斥反应一般发生在移植后3 wk[16], 我们的实验发现L02细胞移植后8 wk仍具有合成白蛋白的功能. 因此, 本实验在诱导免疫耐受基础上进行的人肝细胞异种移植, 移植细胞的消亡不是因为与宿主的免疫排斥反应, 而是移植细胞有限的增殖能力[17]. 但实验同时发现, 2-AAF实验组(小、中、大剂量)均与对照组无显著区别, 证明2-AAF对移植L02细胞无明显增殖作用.
亲脂性碳花青荧光染料DiI标记整个细胞[18], 对活体细胞无毒性, 不会影响细胞活性和基本生理特性, 不从已标记的细胞转移到未标记的细胞, 且荧光衰减慢[19]. 有报道标记的神经元在体外保持4 wk以上, 而体内保持活性9 mo以上, 仍没有明显衰减和向周围的神经元细胞转移[20]. 运用DiI对SD大鼠进行脾内肝细胞移植示踪观察, 发现经DiI标记的肝细胞容易从宿主组织中辨认出来, 荧光L02细胞移植到鼠肝后, 数目逐渐减少, 亮度逐渐减弱, 不同时相的DiI及免疫组化均显示了L02细胞的分布: 移植的L02细胞首先到达受体鼠肝内的远端门静脉区域和肝窦, 聚集成团分布, 以后逐渐扩散到肝实质区域, 并呈散在分布[21]. 3种剂量实验组和对照组结果未见明显区别. 移植10 wk的荧光点基本消失, 可能是残余移植细胞活性下降, 也可能意味着细胞死亡或其碎片为吞噬细胞吞噬. 该荧光剂显示时间较长, 较好显示了L02细胞整合后的存活情况. 同时, 通过免疫组化和免疫荧光发现, 植入肝细胞还表达了合成白蛋白及增殖功能.
我们应用的肝毒性药物2-AAF是一种致癌药物, 他在肝细胞内可被Ⅰ相代谢酶分解为具有肝细胞毒性的N-羟基衍生物, 该物质为细胞有丝分裂的抑制剂, 可有效抑制肝实质细胞的增殖. 胆管上皮细胞及幼稚的肝卵圆细胞内富含Ⅱ相酶, 可将肝细胞致癌剂解毒, Ⅰ相酶的含量则极低, 故2-AAF不能抑制此类细胞的增殖. 此时给予PH, 在肝细胞再生需求下, 由于2-AAF抑制了肝细胞的增殖, 促进胆管上皮细胞向卵圆细胞大量增殖[22]. 70% PH是最常见的大鼠肝再生模型, 肝严重损伤后的再生主要是肝前体细胞即卵圆细胞或小肝细胞的增殖与分化的过程, 可能少量的成熟肝细胞通过大量增殖来参与肝脏的再生与修复[23]. 2-AAF是常用于卵圆细胞活化的肝毒性药物, 阻断受体肝细胞的DNA合成, 从而抑制肝细胞的增殖[24-25], 在肝细胞再生需求下, 可促进卵圆细胞的活化, 但是否能促进移植细胞在嵌合肝中的增殖却少有报道. 计算机图像分析和统计学分析, 检测不同时相PCNA细胞的数密度和面积密度. PCNA在静止期细胞中量很少, G1晚期开始增加, S期达到高峰[26]. 可作为评价移植肝细胞增殖状态的指标[27]. 我们从移植后2, 4, 6 wk大鼠肝组织中检出细胞核为棕色的特异性人PCNA阳性细胞, 表明此期间嵌合鼠体内有处于增殖期的人肝细胞存在. 特异性人PCNA作一抗时, 实验组与对照组在时间和数量上均无明显差异, 说明2-AAF虽能抑制受体肝细胞增殖, 促进卵圆细胞的增殖分化, 但未能促进移植肝细胞的增殖; 4 wk PCNA细胞数量最多, 提示移植肝细胞在4 wk时增殖能力最高; 8 wk PCNA细胞基本消失, 即L02细胞增殖能力消失, 但荧光与组化显示, 仍存在活的移植细胞并具备一定的功能. 非特异性PCNA作一抗时, 实验组与对照组也无明显差异, 自1 wk出现阳性胞核后, 不同时相检测一直持续存在且数量很多, 说明鼠肝细胞在行PH后迅速表现出强烈的增殖趋势, 对照组受体肝细胞及移植肝细胞均开始增殖, 由于此类模型可能以卵圆细胞增殖为主, 且移植肝细胞数量远远少于受体肝细胞, 所以, PH促进L02细胞的增殖能力非常有限[28]; 实验组由于2-AAF广泛破坏受体肝细胞的DNA合成, 使受体肝细胞增殖受阻, 而此类模型可能以卵圆细胞增殖为主, 即使阻断了受体成年肝细胞增殖, L02细胞的增殖比例仍然很小. 由于移植肝细胞数量在嵌合肝中比例很小, PH促进L02细胞增殖的数量很少, 所以, 非特异性PCNA在1 wk出现, 而特异性人PCNA在1 wk未能发现, 且在相应时相, 特异性人PCNA与非特异性PCNA比较数量明显稀少.
本研究证实, L02细胞宫内诱导胎鼠产生免疫耐受, 出生后移植到实验鼠肝内, 可成功建立针对移植物耐受的动物模型, 移植的L02细胞可以在嵌合鼠体内整合、增殖, 并具有一定的生物学功能; 但是, 2-AAF不能促进移植肝细胞的增殖, L02细胞在正常免疫活性的大鼠肝内存活未超过10 wk. 为提高移植肝细胞在宿主肝内的生存时间和比例, 有待进一步应用其他方法促进移植肝细胞的增殖, 从而建立长期有效的动物模型.
人鼠嵌合肝是将人肝细胞移植到受体鼠肝脏内建立的动物模型, 但是, 直接给予受体 鼠移植人肝细胞, 移植细胞的存活数量与时间很有限, 移植细胞在受体肝内的增殖是其存活及发挥功能的关键, 要建立稳定持久的人鼠 嵌合肝动物模型, 必须提高移植细胞的增殖能力.
目前常用肝脏毒性药物首先阻断受体细胞的细胞周期, 抑制其增殖, 联合再生刺激作用, 二者共同促进移植肝细胞增殖. 本研究采用卵圆细胞活化的基本模型, 即2-AAF与部分肝切除术联合, 观察2-AAF促进人鼠嵌合肝中移植细胞的增殖能力.
在诱导免疫耐受的人鼠嵌合肝动物模型基础上, 应用肝毒性药物2-AAF, 抑制受体肝细胞的增殖, 明确其提高移植细胞增殖功能. 同时, 对人鼠嵌合肝中移植细胞进行多样化检测: DiI示踪法动态显示其生存及分布; 免疫荧光证实移植细胞具有一定的生物学功能; 免疫组化对PCNA的检测, 及计算机细胞图像分析系统定量分析数密度和面积密度反映了移植细胞的增殖情况.
本研究证实, L02细胞宫内诱导胎鼠产生免疫耐受, 出生后移植到实验鼠肝内, 移植细胞可以在嵌合鼠体内整合、增殖, 并具有一定的生物学功能; 但是, 2-AAF不能促进移植肝细胞的增殖, 有待进一步应用其他方法. 建立长期稳定的动物模型, 从理论和实践中都能够证明人鼠嵌合肝动物模型的应用前景, 构建在正常免疫系统基础上的动物模型, 可为进一步研究病毒感染免疫应答、致病机制、抗病毒治疗等提供新的方法.
人鼠嵌合肝: 是利用人肝细胞异种移植方法建立的新型动物模型, 是人肝细胞移植后在受体鼠体内存活、增殖, 并具有其正常的生物学功能. 诱导免疫耐受建立的人鼠嵌合肝动物模型, 可进行已知和未知肝炎致病因子的研究.
林沪, 毛青, 王宇明所领导的感染病研究所在国内小有名气. 他们研究的人鼠嵌合动物模型对研究病毒性、代谢性肝病的发病机制及治疗药物、疫苗研发等提供了新的技术手段, 具有良好的前景和发展意义. 文章具有较高的学术价值和理论意义, 属于国内领先水平.
电编:张敏 编辑:潘伯荣
| 1. | Mizuguchi T, Mitaka T, Katsuramaki T, Hirata K. Hepatocyte transplantation for total liver repopulation. J Hepatobiliary Pancreat Surg. 2005;12:378-385. [PubMed] |
| 2. | Laconi E, Laconi S. Principles of hepatocyte repopulation. Semin Cell Dev Biol. 2002;13:433-438. [PubMed] |
| 3. | Fandrich F, Ruhnke M. Stem cells and liver replacement. Med Klin (Munich). 2003;98 Suppl 2:18-22. [PubMed] |
| 4. | Witek RP, Fisher SH, Petersen BE. Monocrotaline, an alternative to retrorsine-based hepatocyte transplantation in rodents. Cell Transplant. 2005;14:41-47. [PubMed] |
| 5. | Menthena A, Deb N, Oertel M, Grozdanov PN, Sandhu J, Shah S, Guha C, Shafritz DA, Dabeva MD. Bone marrow progenitors are not the source of expanding oval cells in injured liver. Stem Cells. 2004;22:1049-1061. [PubMed] |
| 6. | Shafritz DA, Dabeva MD. Liver stem cells and model systems for liver repopulation. J Hepatol. 2002;36:552-564. [PubMed] |
| 7. | Guha C, Deb NJ, Sappal BS, Ghosh SS, Roy-Chowdhury N, Roy-Chowdhury J. Amplification of engrafted hepatocytes by preparative manipulation of the host liver. Artif Organs. 2001;25:522-528. [PubMed] |
| 8. | Okumoto K, Saito T, Haga H, Hattori E, Ishii R, Karasawa T, Suzuki A, Misawa K, Sanjo M, Ito JI. Charac-teristics of rat bone marrow cells differentiated into a liver cell lineage and dynamics of the transplanted cells in the injured liver. J Gastroenterol. 2006;41:62-69. [PubMed] |
| 9. | Alison M, Golding M, Lalani EN, Nagy P, Thorgeirsson S, Sarraf C. Wholesale hepatocytic differentiation in the rat from ductular oval cells, the progeny of biliary stem cells. J Hepatol. 1997;26:343-352. [PubMed] |
| 10. | Chen Y, Wang Y, Li J, Lang S. Establishment and optimization of rat models for hepatic oval cells proliferation. Zhonghua Ganzangbing Zazhi. 2002;10:185-187. [PubMed] |
| 12. | Gupta S, Lee CD, Vemuru RP, Bhargava KK. 111Indium labeling of hepatocytes for analysis of short-term biodistribution of transplanted cells. Hepatology. 1994;19:750-757. [PubMed] |
| 13. | Koenig S, Stoesser C, Krause P, Becker H, Markus PM. Liver repopulation after hepatocellular transplantation: integration and interaction of transplanted hepatocytes in the host. Cell Transplant. 2005;14:31-40. [PubMed] |
| 14. | Laconi E, Oren R, Mukhopadhyay DK, Hurston E, Laconi S, Pani P, Dabeva MD, Shafritz DA. Long-term, near-total liver replacement by transplanta-tion of isolated hepatocytes in rats treated with retrorsine. Am J Pathol. 1998;153:319-329. [PubMed] |
| 15. | Wu CH, Ouyang EC, Walton C, Promrat K, Forouhar F, Wu GY. Hepatitis B virus infection of transplanted human hepatocytes causes a biochemi-cal and histological hepatitis in immunocopetentent rats. World J Gastroenterol. 2003;9:978-983. [PubMed] |
| 16. | Song E, Chen J, Antus B, Su F, Wang M, Exton MS. Adenovirus-mediated Bcl-2 gene transfer inhibits apoptosis and promotes survival of allogeneic transplanted hepatocytes. Surgery. 2001;130:502-511. [PubMed] |
| 17. | Oertel M, Rosencrantz R, Chen YQ, Thota PN, Sandhu JS, Dabeva MD, Pacchia AL, Adelson ME, Dougherty JP, Shafritz DA. Repopulation of rat liver by fetal hepatoblasts and adult hepatocytes transduced ex vivo with lentiviral vectors. Hepatology. 2003;37:994-1005. [PubMed] |
| 18. | Gerashchenko BI, Howell RW. Flow cytometry as a strategy to study radiation-induced bystander effects in co-culture systems. Cytometry A. 2003;54:1-7. [PubMed] |
| 19. | Zhou BJ, Zhong CP, Gu YD, Zhang XH, Liang CM, Wu CQ. Effects of hepatectomized rat serum on the transdifferentiation of adult rat bone marrow cells into hepatocyte-like cells. Zhonghua Ganzangbing Zazhi. 2004;12:730-733. [PubMed] |
| 20. | Vidal-Sanz M, Villegas-Perez MP, Bray GM, Aguayo AJ. Persistent retrograde labeling of adult rat retinal ganglion cells with the carbocyanine dye diI. Exp Neurol. 1988;102:92-101. [PubMed] |
| 21. | Okumoto K, Saito T, Haga H, Hattori E, Ishii R, Karasawa T, Suzuki A, Misawa K, Sanjo M, Ito JI. Characteristics of rat bone marrow cells differentiat-ed into a liver cell lineage and dynamics of the transplanted cells in the injured liver. J Gastroenterol. 2006;41:62-69. [PubMed] |
| 22. | Petersen BE, Zajac VF, Michalopoulos GK. Hepatic oval cell activation in response to injury following chemically induced periportal or pericentral damage in rats. Hepatology. 1998;27:1030-1038. [PubMed] |
| 23. | Mitaka T. Hepatic stem cells: from bone marrow cells to hepatocytes. Biochem Biophys Res Commun. 2001;281:1-5. [PubMed] |
| 24. | Paku S, Dezso K, Kopper L, Nagy P. Immunohisto-chemical analysis of cytokeratin 7 expression in resting and proliferating biliary structures of rat liver. Hepatology. 2005;42:863-870. [PubMed] |
| 25. | Petersen BE, Bowen WC, Patrene KD, Mars WM, Sullivan AK, Murase N, Boggs SS, Greenberger JS, Goff JP. Bone marrow as a potential source of hepatic oval cells. Science. 1999;284:1168-1170. [PubMed] |
| 26. | Majka J, Burgers PM. The PCNA-RFC families of DNA clamps and clamp loaders. Prog Nucleic Acid Res Mol Biol. 2004;78:227-260. [PubMed] |
| 27. | Muskhelishvili L, Latendresse JR, Kodell RL, Henderson EB. Evaluation of cell proliferation in rat tissues with BrdU, PCNA, Ki-67(MIB-5) immuno-histochemistry and in situ hybridization for histone mRNA. J Histochem Cytochem. 2003;51:1681-1688. [PubMed] |
| 28. | Zheng YW, Ohkohchi N, Taniguchi H. Quantitative evaluation of long-term liver repopulation and the reconstitution of bile ductules after hepatocellular transplantation. World J Gastroenterol. 2005;11:6176-6181. [PubMed] |