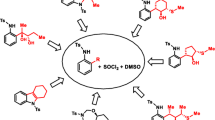
Abstract
N-Aryl-S,S-dimethyl sulfimides may be rearranged to yield o-methylthiomethyl anilines either in aprotic solvents in presence of bases (triethyl amine) or in protic solvents (alcohols, water) without addition of base. The rate of the rearrangement is determined by the rate of proton abstraction from one of the S-methyl groups as well as by the position of the equilibrium for protomation of the nitrogen atom, as indicated by kinetic isotope effects and the influence of p-substituents, respectively. The rearrangement of the intermediate S-ylide is faster than its reprotonation by protic solvents and represents a sigmatropic [2.3]-migration.
Zusammenfassung
N-Aryl-S,S-dimethylsulfimide können entweder in aprotischen Lösungsmitteln in Gegenwart von Basen (Triäthylamin) oder in protischen Lösungsmitteln (Alkohole, Wasser) ohne Zusatz von Basen in o-Methylthiomethylaniline umgelagert werden. Die Geschwindigkeit der Umlagerung wird bestimmt von der Abspaltung eines Protons aus einer S-Methylgruppe und von der Lage des Gleichgewichts für die Protonierung am Stickstoffatom, was aus einem kinetischen Isotopeneffekt und aus der Richtung des Einflusses von p-Substituenten geschlossen wurde. Die eigentliche Umlagerung des intermediären S-Ylids ist rascher als seine Reprotonierung durch protische Lösungsmittel und entspricht einer sigmatropen [2,3]-Verschiebung.
Similar content being viewed by others
Literatur
P. Claus undW. Vycudilik, Tetrahedron Lett.1968, 3607; Mh. Chem.101, 396, 405 (1970).
C. R. Hauser, S. W. Kantor undP. H. Weinheimer, J. Amer. Chem. Soc.73, 4122 (1951).
M. G. Burdon undJ. G. Moffatt, J. Amer. Chem. Soc.87, 4656 (1965);88, 5855 (1966);89, 4725 (1967).
V. Rautenstrauch, Chem. Comm.1970, 4.
R. B. Bates undD. Feld, Tetrahedron Lett.1968, 417.
W. Kirmse undM. Kapps, Chem. Ber.101, 1004 (1968).
M. Yoshimine undM. J. Hatch, J. Amer. Chem. Soc.89, 5831 (1967).
Die ersten Synthesen von 4-CN-1 und 4-COOCH3-1 danken wir Herrn Dr.W. Vycudilik.
Author information
Authors and Affiliations
Additional information
Mit 4 Abbildungen
Herrn Prof. Dr.O. Kratky zum 70. Geburtstag gewidmet.
7. Mitt.:P. Claus, W. Vycudilik undW. Rieder, Mh. Chem.102, 1571 (1971).
Teile der Ergebnisse über die Umlagerung des N-4-Chlorphenyl-S,S-dimethylsulfimids sind in der DissertationW. Rieder, Univ. Wien (1971), enthalten.
Rights and permissions
About this article
Cite this article
Claus, P., Rieder, W. Zum Mechanismus der Umlagerung von N-Aryl-S,S-dimethylsulfimiden zu o-Methylthiomethylanilinen. Monatshefte für Chemie 103, 1163–1177 (1972). https://doi.org/10.1007/BF00905193
Received:
Issue Date:
DOI: https://doi.org/10.1007/BF00905193